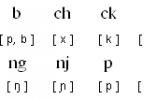शिक्षा के लिए संघीय एजेंसी
उच्च व्यावसायिक शिक्षा के राज्य शैक्षिक संस्थान "यूराल राज्य तकनीकी विश्वविद्यालय - यूपीआई"
पूर्वाह्न। पैन्फिलोव
शैक्षिक इलेक्ट्रॉनिक पाठ संस्करण
"धातुकर्म प्रक्रियाओं का सिद्धांत" विभाग द्वारा तैयार किया गया
वैज्ञानिक संपादक: प्रोफेसर, डॉक्टर. रसायन. विज्ञान एम.ए. स्पीरिदोनोव
धातुकर्म विशिष्टताओं में प्रशिक्षण के सभी रूपों के छात्रों के लिए "धातुकर्म प्रणालियों और प्रक्रियाओं के भौतिक-रसायन विज्ञान", "धातुकर्म प्रक्रियाओं के सिद्धांत" विषयों में प्रयोगशाला कार्य के लिए दिशानिर्देश।
टीएमपी विभाग (विशेष दर्शक) की कार्यशाला "धातुकर्म प्रक्रियाओं का सिद्धांत" में काम के आयोजन के नियम विनियमित हैं
माउंट-431 के नाम पर रखा गया। ओ.ए. एसिना)। प्रयोगशाला कार्य करने की पद्धति और प्रक्रिया का वर्णन किया गया है, वर्तमान GOST के अनुसार प्रयोगशाला कार्य पर रिपोर्ट की सामग्री और प्रारूपण की आवश्यकताएं और उनके कार्यान्वयन के लिए सिफारिशें दी गई हैं।
© उच्च व्यावसायिक शिक्षा राज्य शैक्षणिक संस्थान यूएसटीयू-यूपीआई, 2008
Ekaterinburg
परिचय................................................. ....... ................................................... ......................................................... .................... 4
1 धातुकर्म प्रक्रियाओं के सिद्धांत पर एक प्रयोगशाला कार्यशाला में काम का संगठन................... 4
1.1 प्रयोगशाला कार्य के लिए तैयारी................................................... ....... ................................................... ............... .. 5 1.2 माप परिणामों के प्रसंस्करण और रिपोर्टिंग के लिए सिफारिशें................................... ..........5
1.3.1 आलेखन ग्राफ़................................................... ....... ................................................... .............. ................... 5
1.3.2 प्रयोगात्मक डेटा को सुचारू करना................................................... ....................................................... 7
1.3.5 असतत बिंदुओं के एक सेट द्वारा परिभाषित फ़ंक्शन का संख्यात्मक विभेदन.................................8
डेटा के एक निश्चित सेट का अनुमान लगाना................................................... ........ .................................. 9
1.3.7 परिणामों की प्रस्तुति................................................. ........ ....................................................... ............... ....... 10
2 प्रयोगशाला कार्य का विवरण................................................. ………………………………… ........................... ............. ग्यारह
2.1 लोहे के उच्च तापमान ऑक्सीकरण की गतिकी का अध्ययन (कार्य संख्या 13) ................................... 12
2.1.1 लौह ऑक्सीकरण के सामान्य पैटर्न.................................................. .......... .................................................. .12 2.1.2 प्रयोगों के संचालन के लिए स्थापना और प्रक्रिया का विवरण...................................... ................................... 14
2.1.3 माप परिणामों का प्रसंस्करण और प्रस्तुति.................................................. ........... ................... 15
प्रश्नों पर नियंत्रण रखें................................................... .................................................. ....................... 17
2.2 ऑक्साइड पिघलने की विद्युत चालकता की तापमान निर्भरता का अध्ययन
(कार्य क्रमांक 14) .................................................. ....... ................................................... ......................................................... ....19
2.2.1 स्लैग की विद्युत चालकता की प्रकृति के बारे में सामान्य जानकारी................................... ............... 19
2.2.2 स्थापना और माप प्रक्रिया का विवरण...................................... ............ ................................ 21
2.2.3 कार्य आदेश................................................. ....... ................................................... .............. 23
2.2.4 माप परिणामों का प्रसंस्करण और प्रस्तुति.................................................. ........... ................... 24
प्रश्नों पर नियंत्रण रखें................................................... .................................................. ....................... 25
2.3 एक सिमुलेशन मॉडल पर स्लैग द्वारा धातु डिसल्फराइजेशन की गतिकी का अध्ययन (कार्य संख्या)
15) ............................................................................................................................................................ 26
2.3.1 स्लैग द्वारा धातु डीसल्फराइजेशन की गतिकी के बारे में सामान्य जानकारी................................... ............... ......26
2.3.2 प्रक्रिया का गणितीय मॉडल.................................................. .......... .................................................. .......29
2.3.3 कार्य प्रक्रिया.................................................. ............... ................................... ..................... ...... तीस
2.3.4 माप परिणामों का प्रसंस्करण और प्रस्तुति.................................................. ........... ................... 31
प्रश्नों पर नियंत्रण रखें................................................... .................................................. ....................................... 32
2.4 प्राकृतिक कार्बोनेट के पृथक्करण की प्रक्रियाओं का थर्मोग्राफिक अध्ययन (कार्य संख्या 16) 33
2.4.1 कार्बोनेट पृथक्करण के सामान्य पैटर्न.................................................. .......... .................. 33
2.4.2 स्थापना आरेख और कार्य प्रक्रिया.................................................. .......... ................................... 39
2.4.3 माप परिणामों का प्रसंस्करण और प्रस्तुति.................................................. ........... ................... 39
प्रश्नों पर नियंत्रण रखें................................................... .................................................. .......................41
2.5 ऑक्साइड पिघलने की चिपचिपाहट की तापमान निर्भरता का अध्ययन (कार्य संख्या 17) ..................42
2.5.1 पिघले ऑक्साइड के श्यान प्रतिरोध की प्रकृति.................................................. ............... ................42
2.5.2 चिपचिपाहट मापने के लिए स्थापना और प्रक्रिया का विवरण...................................... ............ .................... 43
2.5.3 कार्य प्रक्रिया.................................................. ............... ................................... ...................... ......45
2.5.4 माप परिणामों का प्रसंस्करण और प्रस्तुति.................................................. ........... ................... 45 परीक्षण प्रश्न................... .................. .................................. ....................... .................................. .................46
2.6 पिघले ऑक्साइड से मैंगनीज का स्टील में अपचयन (कार्य संख्या 18)
2.6.1 धातु और धातुमल के बीच विद्युत रासायनिक संपर्क के सामान्य सिद्धांत......................................47
2.6.2 प्रक्रिया मॉडल................................................. ....... ................................................... .........................................49
2.6.3 कार्य प्रक्रिया................................................. ............... ................................... ...................... ......50
प्रश्नों पर नियंत्रण रखें................................................... .................................................. ...... ................................... 52 सन्दर्भ............... ………………………………… ................................... ....................... .................................. ......53
| एसटीपी यूएसटीयू-यूपीआई 1-96 |
उद्यम मानक. डिप्लोमा और पाठ्यक्रम परियोजनाएं (कार्य) तैयार करने के लिए सामान्य आवश्यकताएं और नियम। |
| गोस्ट आर 1.5-2002 |
जीएसएस. मानक। निर्माण, प्रस्तुति, डिज़ाइन, सामग्री और पदनाम के लिए सामान्य आवश्यकताएँ। |
| गोस्ट 2.105-95 |
ईएसकेडी. पाठ दस्तावेज़ों के लिए सामान्य आवश्यकताएँ। |
| गोस्ट 2.106-96 |
ईएसकेडी. पाठ दस्तावेज़. |
| गोस्ट 6.30 2003 |
USD। संगठनात्मक और प्रशासनिक दस्तावेज़ीकरण की एकीकृत प्रणाली। प्रलेखन की आवश्यकता। |
| गोस्ट 7.32-2001 |
सिबिड. अनुसंधान रिपोर्ट। |
| गोस्ट 7.54-88 |
सिबिड. वैज्ञानिक और तकनीकी दस्तावेजों में पदार्थों और सामग्रियों के गुणों पर संख्यात्मक डेटा की प्रस्तुति। सामान्य आवश्यकताएँ। |
| गोस्ट 8.417-2002 |
जीएसओईआई. मात्राओं की इकाइयाँ |
संकेतन और संक्षिप्तीकरण
| पूर्व यूएसएसआर का राज्य मानक या अंतरराज्यीय मानक (वर्तमान में)। |
|
| मानकीकरण और मेट्रोलॉजी के लिए रूसी संघ की राज्य समिति (रूस के गोस्स्टैंडर्ट) या आवास और निर्माण नीति पर रूसी संघ की राज्य समिति (रूस के गोस्स्ट्रॉय) द्वारा अपनाया गया एक मानक। |
|
| राज्य मानकीकरण प्रणाली. |
|
| माप की एकरूपता सुनिश्चित करने के लिए राज्य प्रणाली। |
|
| सूचान प्रौद्योगिकी |
|
| न्यूनतम वर्ग विधि |
|
| निजी कंप्यूटर |
|
| उद्यम मानक |
|
| धातुकर्म प्रक्रियाओं का सिद्धांत |
परिचय
धातु-स्लैग प्रणाली में गुणों और धातुकर्म इकाइयों में होने वाली प्रक्रियाओं का अध्ययन करने के लिए प्रयोगशाला कार्य करने से हमें विश्लेषण की भौतिक रासायनिक पद्धति की क्षमताओं को बेहतर ढंग से समझने और इसके व्यावहारिक अनुप्रयोग में कौशल हासिल करने की अनुमति मिलती है। इसके अतिरिक्त, छात्र सामान्य रूप से व्यक्तिगत भौतिक रासायनिक गुणों और धातुकर्म प्रक्रियाओं के प्रयोगात्मक और मॉडल अनुसंधान के कुछ तरीकों के कार्यान्वयन से परिचित हो जाता है, प्रयोगात्मक जानकारी के प्रसंस्करण, विश्लेषण और प्रस्तुत करने में कौशल प्राप्त करता है।
1 धातुकर्म प्रक्रियाओं के सिद्धांत पर एक प्रयोगशाला कार्यशाला में काम का संगठन
धातुकर्म प्रक्रियाओं के सिद्धांत पर एक प्रयोगशाला कार्यशाला में, मुख्य बात प्रयोगात्मक जानकारी का कंप्यूटर संग्रह है। यह कार्य के संगठन की कई विशेषताएं निर्धारित करता है:
प्रत्येक छात्र को एक व्यक्तिगत कार्य मिलता है, वह संपूर्ण प्रयोग या उसका एक निर्दिष्ट भाग पूरा करता है, और प्राप्त जानकारी को संसाधित करता है। कार्य के परिणाम में अध्ययन की जा रही घटना की प्राप्त संख्यात्मक विशेषताएं और उनके निर्धारण में त्रुटियां, पहचानी गई विशेषताओं को दर्शाने वाले ग्राफ़ और जानकारी के पूरे सेट से प्राप्त निष्कर्ष शामिल हैं। नियंत्रण ग्रेड की तुलना में छात्र रिपोर्ट में दिए गए कार्य के मात्रात्मक परिणामों के बीच विसंगति 5% से अधिक नहीं होनी चाहिए।
परिणामों को फ़ॉर्मेट करने का मुख्य विकल्प प्रयोगात्मक डेटा को संसाधित करना, ग्राफ़ बनाना और Microsoft.Excel या OpenOffice.calc स्प्रेडशीट में निष्कर्ष तैयार करना है।
शिक्षक की अनुमति से, ग्राफ़ पेपर पर बने आवश्यक चित्रों और ग्राफ़ के साथ हस्तलिखित रिपोर्ट प्रस्तुत करना अस्थायी रूप से संभव है।
पूर्ण किए गए प्रयोगशाला कार्य की रिपोर्ट प्रयोगशाला कार्यशाला आयोजित करने वाले शिक्षक को अगले प्रयोगशाला कार्य से पहले के कार्य दिवस पर प्रस्तुत की जाती है। ट्रांसमिशन का क्रम (ई-मेल द्वारा, ब्रेक के दौरान किसी शिक्षक या वर्तमान में कक्षाओं का नेतृत्व करने वाले प्रयोगशाला सहायक को) शिक्षक द्वारा निर्धारित किया जाता है।
जिन छात्रों ने पिछले काम पर समय पर रिपोर्ट जमा नहीं की है और बोलचाल (परीक्षण) में उत्तीर्ण नहीं हुए हैं, उन्हें अगले प्रयोगशाला कार्य में भाग लेने की अनुमति नहीं है।
केवल वे छात्र जिन्होंने प्रयोगशाला कार्यशाला में सुरक्षित कार्य उपायों पर एक परिचयात्मक ब्रीफिंग पूरी कर ली है और निर्देश रिकॉर्ड शीट पर हस्ताक्षर कर दिए हैं, उन्हें प्रयोगशाला कार्य करने की अनुमति है।
रासायनिक कांच के बर्तनों और अभिकर्मकों के साथ विद्युत उपकरणों को गर्म करने और मापने का काम प्रयोगशाला में सुरक्षा निर्देशों के अनुसार किया जाता है।
काम पूरा करने के बाद, छात्र कार्यस्थल को साफ-सुथरा करता है और इसे प्रयोगशाला सहायक को सौंप देता है।
1.1 प्रयोगशाला कार्य के लिए तैयारी
पाठ की तैयारी करते समय मुख्य स्रोत यह मैनुअल, व्याख्याता द्वारा अनुशंसित पाठ्यपुस्तकें और शिक्षण सहायक सामग्री और व्याख्यान नोट्स हैं।
प्रयोगशाला कार्य की तैयारी में, पाठ से पहले सप्ताह के दौरान, छात्र को अध्ययन की जा रही घटना से संबंधित सामग्री को पढ़ना और समझना चाहिए, स्थापना और माप विधियों के डिजाइन को समझना चाहिए और मैनुअल में दिए गए आरेखों का उपयोग करके परिणामों को संसाधित करना चाहिए। यदि कठिनाइयाँ आती हैं, तो अनुशंसित साहित्य का उपयोग करना और प्रयोगशाला कक्षाएं संचालित करने वाले व्याख्याता और शिक्षकों के साथ परामर्श करना आवश्यक है।
कार्य करने के लिए छात्र की तत्परता को शिक्षक द्वारा प्रत्येक छात्र का व्यक्तिगत रूप से साक्षात्कार करके या कंप्यूटर परीक्षण करके नियंत्रित किया जाता है। अपर्याप्त रूप से तैयार छात्र को पाठ के दौरान इस कार्य से संबंधित सामग्री का अध्ययन करना होता है, और पुन: परीक्षण के बाद अतिरिक्त पाठ में कार्य के प्रायोगिक भाग को पूरा करना होता है। बार-बार कक्षाओं के लिए समय और प्रक्रिया को एक विशेष कार्यक्रम द्वारा नियंत्रित किया जाता है।
1.2 माप परिणामों के प्रसंस्करण और रिपोर्टिंग के लिए सिफारिशें
GOST 7.54-88 के अनुसार, प्रायोगिक संख्यात्मक डेटा को शीर्षक तालिकाओं के रूप में प्रस्तुत किया जाना चाहिए। प्रत्येक प्रयोगशाला के लिए नमूना तालिकाएँ प्रदान की गई हैं।
माप परिणामों को संसाधित करते समय, सांख्यिकीय प्रसंस्करण का उपयोग करना आवश्यक है: प्रयोगात्मक डेटा की स्मूथिंग लागू करें, निर्भरता मापदंडों का अनुमान लगाते समय कम से कम वर्ग विधि का उपयोग करें, आदि। और प्राप्त मूल्यों की त्रुटि का मूल्यांकन करना सुनिश्चित करें। ऐसी प्रोसेसिंग करने के लिए स्प्रेडशीट में विशेष सांख्यिकीय कार्य प्रदान किए जाते हैं। वैज्ञानिक (इंजीनियरिंग) गणना के लिए इच्छित कैलकुलेटर में कार्यों का आवश्यक सेट भी उपलब्ध है।
1.3.1 रेखांकन
प्रयोग करते समय, एक नियम के रूप में, कई मापदंडों के मान एक साथ दर्ज किए जाते हैं। उनके संबंधों का विश्लेषण करके, हम देखी गई घटना के बारे में निष्कर्ष निकाल सकते हैं। संख्यात्मक डेटा का दृश्य प्रतिनिधित्व उनके संबंधों का विश्लेषण करना बेहद आसान बनाता है - यही कारण है कि जानकारी के साथ काम करने में रेखांकन इतना महत्वपूर्ण कदम है। ध्यान दें कि निश्चित मापदंडों के बीच हमेशा कम से कम एक स्वतंत्र चर होता है - एक मान जिसका मान अपने आप (समय) बदलता है या जो प्रयोगकर्ता द्वारा निर्धारित किया जाता है। शेष पैरामीटर स्वतंत्र चर के मानों द्वारा निर्धारित किए जाते हैं। ग्राफ़ बनाते समय, आपको कुछ नियमों का पालन करना चाहिए:
स्वतंत्र चर का मान x-अक्ष (क्षैतिज अक्ष) के साथ प्लॉट किया जाता है, और फ़ंक्शन का मान ऑर्डिनेट अक्ष (ऊर्ध्वाधर अक्ष) के साथ प्लॉट किया जाता है।
अक्षों के साथ तराजू को चुना जाना चाहिए ताकि ग्राफ़ क्षेत्र का यथासंभव जानकारीपूर्ण उपयोग किया जा सके - ताकि कम खाली क्षेत्र हों जहां कोई प्रयोगात्मक बिंदु और कार्यात्मक निर्भरता की रेखाएं न हों। इस आवश्यकता को पूरा करने के लिए, समन्वय अक्ष के मूल पर एक गैर-शून्य मान निर्दिष्ट करना अक्सर आवश्यक होता है। इस मामले में, सभी प्रयोगात्मक परिणाम ग्राफ़ पर प्रस्तुत किए जाने चाहिए।
अक्षों के अनुदिश मान, एक नियम के रूप में, किसी पूर्णांक (1, 2, 4, 5) के गुणज होने चाहिए और समान दूरी पर होने चाहिए। कुल्हाड़ियों पर विशिष्ट माप के परिणामों को इंगित करना सख्ती से अस्वीकार्य है। चुनी गई स्केल इकाइयाँ बहुत छोटी या बहुत बड़ी नहीं होनी चाहिए (एकाधिक अग्रणी या अनुगामी शून्य नहीं होने चाहिए)। इस आवश्यकता को सुनिश्चित करने के लिए, फॉर्म 10 एक्स के स्केल फैक्टर का उपयोग किया जाना चाहिए, जो अक्ष पदनाम में शामिल है।
कार्यात्मक निर्भरता की रेखा या तो सीधी या चिकनी वक्र होनी चाहिए। प्रारंभिक विश्लेषण के चरण में ही प्रायोगिक बिंदुओं को टूटी हुई रेखा से जोड़ने की अनुमति है।
स्प्रेडशीट का उपयोग करके ग्राफ़ बनाते समय, इनमें से कई आवश्यकताएं स्वचालित रूप से पूरी हो जाएंगी, लेकिन आमतौर पर सभी नहीं और पूरी तरह से नहीं, इसलिए आपको परिणामी प्रतिनिधित्व को लगभग हमेशा समायोजित करना होगा।
स्प्रैडशीट्स की एक विशेष सेवा है - चार्ट विज़ार्ड (मुख्य मेनू: चार्ट सम्मिलित करें)। इसे एक्सेस करने का सबसे सरल तरीका यह है कि पहले कोशिकाओं के एक क्षेत्र का चयन करें जिसमें एक तर्क और एक फ़ंक्शन (कई फ़ंक्शन) दोनों शामिल हों, और माउस के साथ मानक पैनल पर "चार्ट विज़ार्ड" बटन को सक्रिय करें।
इस तरह, आपको शेड्यूल का एक टेम्प्लेट मिलेगा, जिस पर अभी भी काम करने की आवश्यकता है, क्योंकि कई डिफ़ॉल्ट शेड्यूल मापदंडों का स्वचालित चयन संभवतः यह सुनिश्चित नहीं करेगा कि सभी आवश्यकताएं पूरी हो गई हैं।
सबसे पहले, अक्षों पर संख्याओं के आकार और अक्ष लेबल में अक्षरों और लेजेंड में फ़ंक्शन लेबल की जांच करें। यह वांछनीय है कि फ़ॉन्ट का आकार हर जगह समान हो, 10 से कम नहीं और 14 अंक से अधिक नहीं, लेकिन आपको प्रत्येक शिलालेख के लिए अलग से मूल्य निर्धारित करना होगा। ऐसा करने के लिए, कर्सर को रुचि की वस्तु (अक्ष, लेबल, लेजेंड) पर ले जाएं और दायां माउस बटन दबाएं। दिखाई देने वाले संदर्भ मेनू में, "प्रारूप (तत्व)" का चयन करें और "फ़ॉन्ट" लेबल के साथ कागज के टुकड़े पर नए मेनू में, वांछित मान का चयन करें। किसी अक्ष को स्वरूपित करते समय, आपको "स्केल" और "नंबर" लेबल वाले कागज़ की शीट पर मानों को अतिरिक्त रूप से देखना और संभवतः बदलना चाहिए। यदि आप यह नहीं समझते हैं कि प्रस्तावित विकल्प से क्या परिवर्तन होंगे, तो किसी भी विकल्प को आज़माने से न डरें, क्योंकि आप हमेशा Ctrl + Z कुंजी दबाकर, या मुख्य मेनू आइटम "संपादित करें" का चयन करके किए गए परिवर्तनों को अस्वीकार कर सकते हैं - रद्द करें , या मानक टूलबार पर "रद्द करें" बटन पर क्लिक करके।
यदि बहुत सारे बिंदु हैं, और बिखराव छोटा है और रेखा काफी चिकनी दिखती है, तो बिंदुओं को रेखाओं से जोड़ा जा सकता है। ऐसा करने के लिए, चार्ट पर किसी भी बिंदु पर कर्सर ले जाएँ और दायाँ माउस बटन दबाएँ। दिखाई देने वाले संदर्भ मेनू में, "डेटा श्रृंखला प्रारूप" चुनें। एक नई विंडो में, "व्यू" लेबल वाले कागज के एक टुकड़े पर, आपको उचित रंग और रेखा की मोटाई का चयन करना चाहिए, और साथ ही बिंदुओं के रंग, आकार और आकार की जांच करनी चाहिए। यह ठीक इसी प्रकार है कि प्रयोगात्मक डेटा का अनुमान लगाने वाले संबंधों का निर्माण किया जाता है। यदि सन्निकटन एक सीधी रेखा के साथ होता है, तो तर्क भिन्नता की सीमा के किनारों पर दो बिंदु पर्याप्त हैं। स्मूथिंग मापदंडों को समायोजित करने में असमर्थता के कारण स्प्रेडशीट में निर्मित "स्मूथ कर्व" विकल्प का उपयोग करने की अनुशंसा नहीं की जाती है।
1.3.2 प्रयोगात्मक डेटा को सुचारू करना
उच्च तापमान वाले प्रायोगिक प्रतिष्ठानों पर प्राप्त प्रायोगिक डेटा को एक बड़ी यादृच्छिक माप त्रुटि की विशेषता होती है। यह मुख्य रूप से एक शक्तिशाली हीटिंग डिवाइस के संचालन से विद्युत चुम्बकीय हस्तक्षेप द्वारा निर्धारित होता है। परिणामों का सांख्यिकीय प्रसंस्करण यादृच्छिक त्रुटि को काफी कम कर सकता है। यह ज्ञात है कि सामान्य कानून के अनुसार वितरित एक यादृच्छिक चर के लिए, अंकगणितीय माध्य की त्रुटि निर्धारित की जाती है एनमान, में एनएकल माप की त्रुटि से ½ गुना कम। बड़ी संख्या में मापों के साथ, जब यह मान लेना स्वीकार्य है कि एक छोटे खंड पर डेटा का यादृच्छिक बिखराव मूल्य में प्राकृतिक परिवर्तन से काफी अधिक है, तो एक प्रभावी स्मूथिंग तकनीक मापा मूल्य के अगले मूल्य को अंकगणितीय माध्य निर्दिष्ट करना है, इसके चारों ओर एक सममित अंतराल में कई मानों से गणना की जाती है। गणितीय रूप से, इसे सूत्र द्वारा व्यक्त किया जाता है:
 (1.1)
(1.1)
और इसे स्प्रेडशीट में लागू करना बहुत आसान है। यहाँ यमैं माप परिणाम है, और वाई i - इसके स्थान पर उपयोग किया गया स्मूथ मान।
डिजिटल सूचना अधिग्रहण प्रणालियों का उपयोग करके प्राप्त प्रायोगिक डेटा को एक यादृच्छिक त्रुटि की विशेषता होती है, जिसका वितरण सामान्य कानून से काफी भिन्न होता है। इस मामले में, अंकगणितीय माध्य के बजाय माध्यिका का उपयोग करना अधिक प्रभावी हो सकता है। इस मामले में, अंतराल के बीच में मापा गया मान उस मापा मान का मान सौंपा जाता है जो अंकगणितीय माध्य के सबसे करीब निकला। ऐसा प्रतीत होता है कि एल्गोरिथम में एक छोटा सा अंतर परिणाम को बहुत महत्वपूर्ण रूप से बदल सकता है। उदाहरण के लिए, माध्यिका अनुमान विकल्प में, कुछ प्रयोगात्मक परिणामों का उपयोग बिल्कुल नहीं किया जा सकता है; सबसे अधिक संभावना है, यह वही हैं जो वास्तव में हैं
विशेष रूप से बड़ी त्रुटि के साथ "पॉप अप" मान।
1.3.5 असतत बिंदुओं के समूह द्वारा परिभाषित किसी फ़ंक्शन का संख्यात्मक विभेदन
प्रयोगात्मक बिंदुओं को संसाधित करते समय ऐसे ऑपरेशन की आवश्यकता अक्सर उत्पन्न होती है। उदाहरण के लिए, समय पर एकाग्रता की निर्भरता को अलग करके, कोई समय पर और अभिकर्मक की एकाग्रता पर प्रक्रिया की दर की निर्भरता पाता है, जो बदले में, प्रतिक्रिया के क्रम का अनुमान लगाने की अनुमति देता है। किसी फ़ंक्शन के संख्यात्मक विभेदन का संचालन उसके मानों के एक सेट द्वारा निर्दिष्ट ( य) तर्क मानों के संगत सेट के अनुरूप ( एक्स), तर्क में अंतिम परिवर्तन के अंतिम परिवर्तन के अनुपात द्वारा किसी फ़ंक्शन के अंतर के अनुमानित प्रतिस्थापन पर आधारित है:
![]() (1.2)
(1.2)
संख्यात्मक विभेदन प्रारंभिक डेटा की अशुद्धि, श्रृंखला शब्दों को त्यागने आदि के कारण होने वाली त्रुटियों के प्रति संवेदनशील है, और इसलिए इसे सावधानी से किया जाना चाहिए। व्युत्पन्न () के अनुमान की सटीकता बढ़ाने के लिए, वे पहले प्रयोगात्मक डेटा को कम से कम एक छोटे खंड पर सुचारू करने का प्रयास करते हैं, और उसके बाद ही भेदभाव करते हैं। परिणामस्वरूप, सबसे सरल मामले में, समदूरस्थ नोड्स के लिए (तर्क के मान एक दूसरे से समान मात्रा x से भिन्न होते हैं), निम्नलिखित सूत्र प्राप्त होते हैं: पहले में व्युत्पन्न के लिए ( एक्स 1)बिंदु:
 अन्य सभी बिंदुओं पर व्युत्पन्न के लिए ( एक्स), अंतिम को छोड़कर:
अन्य सभी बिंदुओं पर व्युत्पन्न के लिए ( एक्स), अंतिम को छोड़कर:
अंतिम में व्युत्पन्न के लिए ( एक्स) बिंदु:
यदि बहुत अधिक प्रयोगात्मक डेटा है और कई चरम बिंदुओं की उपेक्षा करने की अनुमति है, तो आप मजबूत स्मूथिंग फ़ार्मुलों का उपयोग कर सकते हैं, उदाहरण के लिए, 5 बिंदुओं के लिए:
या 7 अंक से:
नोड्स की असमान व्यवस्था के लिए, हम फॉर्म में संशोधित सूत्र (1.3) का उपयोग करने की सिफारिश करने तक खुद को सीमित रखेंगे
![]() (1.8)
(1.8)
और आरंभ और अंत बिंदुओं पर व्युत्पन्न की गणना न करें।
इस प्रकार, संख्यात्मक विभेदन को लागू करने के लिए, आपको एक मुक्त कॉलम की कोशिकाओं में उपयुक्त सूत्र रखने की आवश्यकता है। उदाहरण के लिए, असमान दूरी वाले तर्क मानों को कक्ष 2 से 25 तक कॉलम "ए" में रखा जाता है, और फ़ंक्शन मान संबंधित कक्षों में कॉलम "बी" में रखे जाते हैं। व्युत्पन्न मानों को कॉलम "सी" में रखा जाना चाहिए। फिर सेल "C3" में आपको फ़ॉर्मूला (5) दर्ज करना चाहिए:
= (बी4 – बी2)/(ए4 – ए2)
और C4:C24 श्रेणी की सभी कोशिकाओं में कॉपी (खिंचाव) करें।
1.3.6 न्यूनतम वर्ग विधि द्वारा बहुपद गुणांकों का निर्धारण,
कुछ डेटा सेट का अनुमान लगाना
संख्यात्मक जानकारी को ग्राफिक रूप से प्रस्तुत करते समय, अक्सर प्रयोगात्मक बिंदुओं के साथ एक रेखा खींचने की आवश्यकता होती है, जो प्राप्त निर्भरता की विशेषताओं को प्रकट करती है। यह जानकारी को बेहतर ढंग से समझने और डेटा के आगे के विश्लेषण को सुविधाजनक बनाने के लिए किया जाता है जिसमें माप त्रुटि के कारण कुछ बिखराव होता है। अक्सर, अध्ययन के तहत घटना के सैद्धांतिक विश्लेषण के आधार पर, यह पहले से ही ज्ञात होता है कि इस रेखा का क्या रूप होना चाहिए। उदाहरण के लिए, यह ज्ञात है कि किसी रासायनिक प्रक्रिया की दर की निर्भरता ( वी) तापमान पर घातीय होना चाहिए, और घातांक निरपेक्ष पैमाने पर व्युत्क्रम तापमान का प्रतिनिधित्व करता है:
 इसका मतलब यह है कि एलएन में ग्राफ़ पर निर्देशांक हैं वी– 1/T का परिणाम एक सीधी रेखा में होना चाहिए,
इसका मतलब यह है कि एलएन में ग्राफ़ पर निर्देशांक हैं वी– 1/T का परिणाम एक सीधी रेखा में होना चाहिए,
जिसका कोणीय गुणांक सक्रियण ऊर्जा को दर्शाता है ( इ) प्रक्रिया। एक नियम के रूप में, प्रयोगात्मक बिंदुओं के माध्यम से विभिन्न ढलानों वाली कई सीधी रेखाएँ खींची जा सकती हैं। एक निश्चित अर्थ में, उनमें से सबसे अच्छा न्यूनतम वर्ग विधि द्वारा निर्धारित गुणांक वाली एक सीधी रेखा होगी।
सामान्य स्थिति में, निर्भरता का अनुमान लगाने वाले गुणांकों को खोजने के लिए न्यूनतम वर्ग विधि का उपयोग किया जाता है य (एक्स 1 , एक्स 2 ,…एक्स एन) रूप का बहुपद
कहाँ बीऔर एम 1 …एम एननिरंतर गुणांक हैं, और एक्स 1 …एक्स एन- स्वतंत्र तर्कों का एक सेट। अर्थात्, सामान्य स्थिति में, विधि का उपयोग कई चरों के एक फ़ंक्शन का अनुमान लगाने के लिए किया जाता है, लेकिन यह एक चर के जटिल फ़ंक्शन का वर्णन करने के लिए भी लागू होता है। एक्स. इस मामले में आमतौर पर यही माना जाता है
 और सन्निकट बहुपद का रूप होता है
और सन्निकट बहुपद का रूप होता है
सन्निकटन बहुपद की घात चुनते समय एनध्यान रखें कि यह मापे गए मानों की संख्या से कम होना चाहिए एक्सऔर य. लगभग सभी मामलों में यह 4 से अधिक नहीं होना चाहिए, शायद ही कभी 5।
यह विधि इतनी महत्वपूर्ण है कि एक्सेल स्प्रेडशीट में आवश्यक गुणांक के मान प्राप्त करने के लिए कम से कम चार विकल्प होते हैं। यदि आप माइक्रोसॉफ्ट ऑफिस में एक्सेल स्प्रेडशीट में काम करते हैं, तो हम LINEST() फ़ंक्शन का उपयोग करने की सलाह देते हैं, या ओपनऑफिस में कैल्क स्प्रेडशीट में LINEST() फ़ंक्शन का उपयोग करने की सलाह देते हैं। उन्हें सांख्यिकीय कार्यों की सूची में प्रस्तुत किया गया है, वे तथाकथित मैट्रिक्स कार्यों के वर्ग से संबंधित हैं और, इसके संबंध में, कई अनुप्रयोग विशेषताएं हैं। सबसे पहले, इसे एक सेल में नहीं, बल्कि तुरंत कोशिकाओं की एक श्रेणी (आयताकार क्षेत्र) में दर्ज किया जाता है, क्योंकि फ़ंक्शन कई मान लौटाता है। क्षेत्र का क्षैतिज आकार अनुमानित बहुपद के गुणांकों की संख्या से निर्धारित होता है (विचाराधीन उदाहरण में दो हैं: ln वी 0 और ई/आर), और लंबवत रूप से एक से पांच पंक्तियों तक आवंटित किया जा सकता है, यह इस बात पर निर्भर करता है कि आपके विश्लेषण के लिए कितनी सांख्यिकीय जानकारी की आवश्यकता है।
1.3.7 परिणामों की प्रस्तुति
संख्यात्मक डेटा प्रस्तुत करते समय, एक वैज्ञानिक और तकनीकी दस्तावेज़ को उनकी विश्वसनीयता का आकलन प्रदान करना चाहिए और यादृच्छिक और व्यवस्थित त्रुटियों को उजागर करना चाहिए। दी गई डेटा त्रुटियों को GOST 8.207-76 के अनुसार प्रस्तुत किया जाना चाहिए।
अवलोकन परिणामों के एक समूह को सांख्यिकीय रूप से संसाधित करते समय, निम्नलिखित ऑपरेशन किए जाने चाहिए: अवलोकन परिणामों से ज्ञात व्यवस्थित त्रुटियों को समाप्त करना;
माप परिणाम के रूप में लिए गए संशोधित अवलोकन परिणामों के अंकगणितीय माध्य की गणना करें; माप परिणाम के मानक विचलन के अनुमान की गणना करें;
माप परिणाम की यादृच्छिक त्रुटि (त्रुटि का यादृच्छिक घटक) की आत्मविश्वास सीमा की गणना करें;
माप परिणाम की गैर-बहिष्कृत व्यवस्थित त्रुटि (व्यवस्थित त्रुटि के गैर-बहिष्कृत अवशेष) की सीमा की गणना करें; माप परिणाम की त्रुटि की विश्वास सीमा की गणना करें।
माप परिणाम की त्रुटि की आत्मविश्वास सीमा निर्धारित करने के लिए, आत्मविश्वास की संभावना आर 0.95 के बराबर लिया गया। सममित आत्मविश्वास त्रुटि के साथ, माप परिणाम इस रूप में प्रस्तुत किए जाते हैं:
माप परिणाम कहां है, ∆ माप परिणाम की त्रुटि सीमा है, आर– आत्मविश्वास की संभावना. माप परिणाम का संख्यात्मक मान त्रुटि मान ∆ के समान अंक के साथ समाप्त होना चाहिए।
2 प्रयोगशाला कार्य का विवरण
विशिष्ट प्रयोगशाला कार्य के लिए समर्पित प्रत्येक खंड का पहला भाग चरणों की संरचना और संरचना, एक चरण के भीतर या पड़ोसी चरणों के साथ इसके इंटरफेस पर होने वाली प्रक्रियाओं के तंत्र के बारे में जानकारी प्रदान करता है, जो अध्ययन की जा रही घटना के सार को समझने के लिए आवश्यक न्यूनतम है। काम। यदि प्रदान की गई जानकारी पर्याप्त नहीं है, तो आपको व्याख्यान नोट्स और अनुशंसित साहित्य का संदर्भ लेना चाहिए। अनुभाग के पहले भाग को समझे बिना, यह कल्पना करना असंभव है कि अध्ययन के तहत प्रणाली में क्या हो रहा है क्योंकि कार्य आगे बढ़ रहा है, प्राप्त परिणामों के आधार पर निष्कर्ष तैयार करना और समझना असंभव है।
प्रत्येक अनुभाग का अगला भाग वास्तविक इंस्टॉलेशन या कंप्यूटर मॉडल के हार्डवेयर या सॉफ़्टवेयर कार्यान्वयन के लिए समर्पित है। यहां आपको उपयोग किए गए उपकरण और उपयोग किए गए एल्गोरिदम के बारे में जानकारी मिलेगी। इस अनुभाग को समझे बिना, त्रुटियों के स्रोतों का आकलन करना और उनके प्रभाव को कम करने के लिए क्या कार्रवाई की जानी चाहिए, इसका आकलन करना असंभव है।
अंतिम भाग माप करने और उनके परिणामों को संसाधित करने की प्रक्रिया का वर्णन करता है। ये सभी प्रश्न प्री-वर्क कॉलोक्वियम या कंप्यूटर परीक्षण के लिए प्रस्तुत किए जाते हैं।
2.1 लोहे के उच्च तापमान ऑक्सीकरण की गतिकी का अध्ययन (कार्य संख्या 13)
2.1.1 लौह ऑक्सीकरण के सामान्य पैटर्न
परिवर्तनों के अनुक्रम के सिद्धांत के अनुसार ए.ए. बैकोव के अनुसार, लोहे की सतह पर, वायुमंडलीय ऑक्सीजन के साथ इसके उच्च तापमान ऑक्सीकरण के दौरान, इन परिस्थितियों में थर्मोडायनामिक रूप से स्थिर सभी ऑक्साइड बनते हैं। 572 डिग्री सेल्सियस से ऊपर के तापमान पर, स्केल में तीन परतें होती हैं: वुस्टाइट FeO, मैग्नेटाइट Fe 3 O 4, हेमेटाइट Fe 2 O 3। लोहे के सबसे करीब वुस्टाइट परत, जो पूरे पैमाने की मोटाई का लगभग 95% है, में है पी-अर्धचालक गुण। इसका मतलब यह है कि FeO के धनायनित उपवर्ग में द्विसंयोजक लौह रिक्तियों की एक महत्वपूर्ण सांद्रता होती है, और इलेक्ट्रॉन "छेद" की उपस्थिति के कारण विद्युत तटस्थता सुनिश्चित होती है, जो फेरिक आयरन के कण होते हैं। वुस्टाइट का आयन सबलैटिस, जिसमें नकारात्मक रूप से चार्ज किए गए O 2-आयन शामिल हैं, व्यावहारिक रूप से दोष-मुक्त है; कटियन सबलैटिस में रिक्तियों की उपस्थिति वुस्टाइट के माध्यम से Fe 2+ कणों की प्रसार गतिशीलता को काफी बढ़ा देती है और इसके सुरक्षात्मक गुणों को कम कर देती है।
मैग्नेटाइट की मध्यवर्ती परत स्टोइकोमेट्रिक संरचना का एक ऑक्साइड है, जिसमें क्रिस्टल जाली में दोषों की कम सांद्रता होती है और परिणामस्वरूप, सुरक्षात्मक गुणों में वृद्धि होती है। इसकी सापेक्ष मोटाई औसतन 4% है।
स्केल की बाहरी परत - हेमेटाइट - में एन-प्रकार की चालकता है। लौह धनायनों की तुलना में, आयन उप-जाल में ऑक्सीजन रिक्तियों की उपस्थिति इसके माध्यम से ऑक्सीजन कणों के प्रसार की सुविधा प्रदान करती है। Fe 2 O 3 परत की सापेक्ष मोटाई 1% से अधिक नहीं है .
572°C से नीचे के तापमान पर, वुस्टाइट थर्मोडायनामिक रूप से अस्थिर होता है, इसलिए स्केल में दो परतें होती हैं: मैग्नेटाइट Fe 3 O 4 (मोटाई का 90%) और हेमेटाइट Fe 2 O 3 (10%)।
लोहे की सतह पर स्केल की एक सतत सुरक्षात्मक फिल्म के बनने से यह वायु वायुमंडल से अलग हो जाता है। ऑक्साइड फिल्म के माध्यम से अभिकर्मकों के प्रसार के कारण धातु का आगे ऑक्सीकरण होता है। विचाराधीन विषम प्रक्रिया में निम्नलिखित चरण शामिल हैं: आणविक या संवहनी प्रसार द्वारा गैस चरण की मात्रा से ऑक्साइड के साथ सीमा तक ऑक्सीजन की आपूर्ति; ऑक्साइड सतह पर O2 सोखना; O2-आयनों के निर्माण के साथ ऑक्सीजन परमाणुओं का आयनीकरण; ऑक्साइड चरण में ऑक्सीजन आयनों का धातु के साथ सीमा तक प्रसार; लोहे के परमाणुओं का आयनीकरण और धनायनों के रूप में पैमाने पर उनका संक्रमण; ऑक्साइड में लौह धनायनों का गैस सीमा तक प्रसार; ऑक्साइड चरण के नए भागों के निर्माण का क्रिस्टल रासायनिक कार्य।
धातु ऑक्सीकरण के प्रसार मोड का एहसास तब होता है जब सबसे बाधित चरण स्केल के माध्यम से Fe 2+ या O 2- कणों का परिवहन होता है। गैस चरण से आणविक ऑक्सीजन की आपूर्ति अपेक्षाकृत तेज़ी से की जाती है। गतिज शासन के मामले में, सीमित चरण कणों का सोखना या आयनीकरण, साथ ही क्रिस्टल रासायनिक परिवर्तन का कार्य है।
तीन-परत पैमाने के मामले में लौह ऑक्सीकरण प्रक्रिया के गतिज समीकरण की व्युत्पत्ति काफी बोझिल है। अंतिम निष्कर्षों को बदले बिना, इसे काफी सरल बनाया जा सकता है, अगर हम पैमाने को संरचना में सजातीय मानते हैं और इसके माध्यम से केवल Fe 2+ धनायनों के प्रसार को ध्यान में रखते हैं।
आइए हम इसे निरूपित करें डीपैमाने में Fe 2+ कणों का प्रसार गुणांक, क– लौह ऑक्सीकरण दर स्थिरांक, सी 1 और साथक्रमशः धातु और वायु के साथ इंटरफ़ेस पर लौह धनायनों की 2 संतुलन सांद्रता, एच-ऑक्साइड फिल्म की मोटाई, एस- नमूना सतह क्षेत्र, - ऑक्साइड घनत्व, एम– इसका दाढ़ द्रव्यमान. फिर, औपचारिक गतिकी के नियमों के अनुसार, नमूने की प्रति इकाई सतह पर ऑक्सीजन के साथ लोहे की रासायनिक प्रतिक्रिया की विशिष्ट दर ( वी आर) संबंध द्वारा निर्धारित होता है:
स्थिर अवस्था में, यह Fe 2+ कणों के प्रसार प्रवाह के घनत्व के बराबर है।
यह ध्यान में रखते हुए कि विषमांगी ऑक्सीकरण प्रक्रिया की समग्र दर उसके द्रव्यमान की वृद्धि दर के समानुपाती होती है
![]() (13.3)
(13.3)
बहिष्कृत किया जा सकता है सीसमीकरण (13.1) और (13.2) से 2 और समय पर पैमाने के द्रव्यमान की निर्भरता प्राप्त करें:
![]() (13.4)
(13.4)
पिछले संबंध से यह स्पष्ट है कि प्रक्रिया की गतिज व्यवस्था, एक नियम के रूप में, ऑक्सीकरण के प्रारंभिक क्षण में महसूस की जाती है, जब ऑक्साइड फिल्म की मोटाई छोटी होती है और इसके प्रसार प्रतिरोध की उपेक्षा की जा सकती है। स्केल परत की वृद्धि अभिकर्मकों के प्रसार को धीमा कर देती है, और प्रक्रिया मोड समय के साथ प्रसार में बदल जाता है।
धातुओं के उच्च तापमान ऑक्सीकरण के आयन-इलेक्ट्रॉन सिद्धांत में वैगनर द्वारा विकसित एक अधिक कठोर दृष्टिकोण ऑक्साइड की विद्युत चालकता पर स्वतंत्र प्रयोगों के डेटा का उपयोग करके फिल्म विकास के परवलयिक कानून की दर स्थिरांक की मात्रात्मक गणना करना संभव बनाता है:
कहाँ ∆ जी- धातु ऑक्सीकरण प्रतिक्रिया के लिए गिब्स ऊर्जा में परिवर्तन, एम– ऑक्साइड का दाढ़ द्रव्यमान, – इसकी विशिष्ट विद्युत चालकता, टी मैं- आयनिक चालकता का अंश, जेड– धातु संयोजकता, एफ– फैराडे स्थिरांक.
बहुत बारीक गठन की गतिकी का अध्ययन करते समय ( एच < 5·10 –9 м) пленок необходимо учитывать также скорость переноса электронов через слой оксида путем туннельного эффекта (теория Хауффе и Ильшнера) и ионов металла под действием электрического поля (теория Мотта и Кабреры). В этом случае окисление металлов сопровождается большим самоторможением во времени при замедленности стадии переноса электронов, чему соответствует логарифмический закон роста пленок एच = कएलएन( ए τ+ बी), साथ ही घन भी एच 3 = कτ (ऑक्साइड - अर्धचालक पी-प्रकार) या व्युत्क्रम लघुगणक 1/ एच = सी कएलएन(τ) ( एन-चालकता का प्रकार) धातु आयन स्थानांतरण चरण की धीमी गति के साथ।
2.1.2 प्रयोगों के संचालन के लिए स्थापना और प्रक्रिया का विवरण
लोहे के ऑक्सीकरण की गतिशीलता का अध्ययन ग्रेविमेट्रिक विधि का उपयोग करके किया जाता है, जो प्रयोग के दौरान समय के साथ नमूने के द्रव्यमान में परिवर्तन को रिकॉर्ड करना संभव बनाता है। स्थापना आरेख चित्र 1 में दिखाया गया है।

चित्र 1 - प्रायोगिक सेटअप आरेख:
1 - अध्ययनाधीन लोहे का नमूना; 2 - विद्युत प्रतिरोध भट्ठी; 3 - मैकेनोइलेक्ट्रिक कनवर्टर ई 2डी1; 4 - एडीसी बोर्ड वाला पर्सनल कंप्यूटर।
E 2D1 मैकेनोइलेक्ट्रिक कनवर्टर (3) के रॉकर आर्म से एक नाइक्रोम श्रृंखला पर निलंबित एक धातु का नमूना (1), विद्युत प्रतिरोध (2) के ऊर्ध्वाधर ट्यूबलर भट्ठी में रखा गया है। आउटपुट सिग्नल E 2D1, नमूना द्रव्यमान में परिवर्तन के आनुपातिक, इंस्टॉलेशन के भाग के रूप में कंप्यूटर के ADC बोर्ड को खिलाया जाता है। भट्ठी में निरंतर तापमान एक स्वचालित नियामक द्वारा बनाए रखा जाता है; प्रयोग के लिए आवश्यक तापमान शिक्षक के निर्देशानुसार भट्ठी डैशबोर्ड पर उपयुक्त डायलर द्वारा निर्धारित किया जाता है (800 - 900 डिग्री सेल्सियस)।
कार्य के परिणामों के आधार पर, लौह ऑक्सीकरण प्रतिक्रिया की दर स्थिरांक और ऑक्साइड फिल्म में इसके आयनों के प्रसार गुणांक और, यदि संभव हो तो, रासायनिक प्रतिक्रिया और प्रसार की सक्रियण ऊर्जा निर्धारित की जाती है। समय पर नमूना द्रव्यमान में परिवर्तन और ऑक्सीकरण प्रक्रिया की दर की निर्भरता को ग्राफिक रूप से चित्रित करें।
2.1.3 माप परिणामों का प्रसंस्करण और प्रस्तुति
मैकेनोइलेक्ट्रिक ट्रांसड्यूसर को इस तरह से डिज़ाइन किया गया है कि मापी गई वस्तु के द्रव्यमान के हिस्से की भरपाई एक सर्पिल स्प्रिंग द्वारा की जाती है। इसका परिमाण अज्ञात है, लेकिन माप के दौरान इसे स्थिर रहना चाहिए। जैसा कि माप तकनीक के विवरण से पता चलता है, ऑक्सीकरण प्रक्रिया की शुरुआत का सटीक समय बिंदु (0) ज्ञात नहीं है, क्योंकि यह ज्ञात नहीं है कि नमूना ऑक्सीकरण प्रक्रिया के विकास के लिए पर्याप्त तापमान कब प्राप्त करेगा। उस समय तक जब नमूना वास्तव में ऑक्सीकरण करना शुरू कर देता है, इसका द्रव्यमान मूल धातु के द्रव्यमान के बराबर होता है ( एम 0). तथ्य यह है कि हम पूरे द्रव्यमान को नहीं मापते हैं, बल्कि केवल उसके अप्रतिपूरित हिस्से को मापते हैं, इससे मामले का सार नहीं बदलता है। नमूने के वर्तमान द्रव्यमान के बीच अंतर ( एम) और धातु का प्रारंभिक द्रव्यमान पैमाने के द्रव्यमान का प्रतिनिधित्व करता है, इसलिए वास्तविक प्रायोगिक स्थितियों के लिए सूत्र (13.4) को इस रूप में प्रस्तुत किया जाना चाहिए:
![]() (13.6)
(13.6)
जिसमें एम- नमूना द्रव्यमान के शेष अप्रतिदेय भाग का मापा मूल्य, म 0- नमूने के कम तापमान पर ऑक्सीकरण प्रक्रिया शुरू होने से पहले भी ऐसा ही होता है। इस संबंध से यह स्पष्ट है कि समय पर नमूना द्रव्यमान की प्रयोगात्मक निर्भरता को फॉर्म के समीकरण द्वारा वर्णित किया जाना चाहिए:
, (13.7)
जिसके गुणांक, प्राप्त माप परिणामों के आधार पर, न्यूनतम वर्ग विधि द्वारा पाए जा सकते हैं। इसे चित्र में एक विशिष्ट ग्राफ़ द्वारा दर्शाया गया है। बिंदु माप परिणाम हैं, रेखा समीकरण 13.7 द्वारा डेटा का अनुमान लगाकर प्राप्त की जाती है

क्रॉस के साथ चिह्नित बिंदु बाहरी हैं और न्यूनतम वर्ग विधि का उपयोग करके समीकरण 13.7 के गुणांक की गणना करते समय इसे ध्यान में नहीं रखा जाना चाहिए।
सूत्रों (13.6) और (13.7) की तुलना करने पर पाए गए गुणांकों को उन भौतिक और रासायनिक मात्राओं से जोड़ना आसान है जो उन्हें निर्धारित करते हैं:
 (13.8)
(13.8)
दिए गए उदाहरण में, m0 का मान - कोटि अक्ष पर = 0 पर मान, 18.1 mg के बराबर निकला।
इन मानों का उपयोग करते हुए, प्रयोग की तैयारी के दौरान प्राप्त नमूना क्षेत्र का मान ( एस) और साहित्य से लिया गया वुस्टाइट का घनत्व (= 5.7 ग्राम/सेमी 3) हो सकता है
प्रसार गुणांक और ऑक्सीकरण प्रक्रिया की दर स्थिरांक के बीच संबंध का अनुमान लगाएं:
![]() (13.13)
(13.13)
यह अनुपात स्केल फिल्म की मोटाई को दर्शाता है जिस पर प्रसार दर स्थिरांक धातु ऑक्सीकरण की रासायनिक प्रतिक्रिया की दर स्थिरांक के बराबर होता है, जो सख्ती से मिश्रित प्रतिक्रिया मोड की परिभाषा से मेल खाता है।
कार्य के परिणामों के आधार पर, सभी मान सूत्रों (13.7, 13.11 – 13.13) का उपयोग करके निर्धारित किए जाने चाहिए: बी 0 , बी 1 , बी 2 , एम 0 , 0 और डी /क. परिणामों को स्पष्ट करने के लिए, निर्भरता का एक ग्राफ़ प्रदान किया जाना चाहिए एम– . प्रयोगात्मक मूल्यों के साथ-साथ, एक अनुमानित वक्र प्रस्तुत करने की सलाह दी जाती है।
माप परिणामों के आधार पर, आपको निम्नलिखित तालिका भरनी होगी:
तालिका 1. लौह ऑक्सीकरण प्रक्रिया के अध्ययन के परिणाम।
किसी तालिका में, डेटा फ़ाइल खोले जाने पर पहले दो कॉलम भरे जाते हैं, और बाकी की गणना की जाती है। स्मूथिंग 5 बिंदुओं पर की जाती है। सन्निकट बहुपद के गुणांकों का निर्धारण करते समय, पहले, तीसरे और चौथे स्तंभों का एक साथ उपयोग किया जाता है। अंतिम कॉलम में न्यूनतम वर्ग विधि द्वारा प्राप्त गुणांकों का उपयोग करके बहुपद (13.7) द्वारा सन्निकटन के परिणाम दिखाए जाने चाहिए। ग्राफ़ पहले, तीसरे और पांचवें कॉलम का उपयोग करके बनाया गया है।
यदि कई छात्र कार्य करते हैं, तो उनमें से प्रत्येक अपने तापमान पर प्रयोग करता है। सख्ती से मिश्रित मोड में स्केल परत की मोटाई का आकलन करने के परिणामों का संयुक्त प्रसंस्करण प्रसार और रासायनिक प्रतिक्रिया की सक्रियण ऊर्जा में अंतर का अनुमान लगाना संभव बनाता है। वास्तव में, स्पष्ट सूत्र यहाँ मान्य है:
![]() (13.14)
(13.14)
गुणांकों का समान प्रसंस्करण बी 2 हमें प्रसार की सक्रियण ऊर्जा का अनुमान लगाने की अनुमति देता है। सूत्र यहाँ सही है:
![]() (13.15)
(13.15)
यदि माप दो तापमानों पर किए गए थे, तो अनुमान सीधे सूत्रों (13.4) और (13.15) का उपयोग करके किए जाते हैं; यदि दो से अधिक तापमान मान हैं, तो कार्यों के लिए कम से कम वर्ग विधि का उपयोग किया जाना चाहिए एल.एन () – 1/टीऔर एल.एन (बी 2) – 1/टी।प्राप्त मान अंतिम तालिका में दिए गए हैं और निष्कर्ष में चर्चा की गई है।
कार्य परिणामों को संसाधित करने की प्रक्रिया
2. एक अलग शीट पर निर्भरता ग्राफ बनाएं एम- , बाह्य मानों को दृष्टिगत रूप से पहचानें और हटाएँ।
3. मापे गए द्रव्यमान मूल्यों को सुचारू करें।
4. द्रव्यमान परिवर्तन के वर्गों की गणना करें
5. न्यूनतम वर्ग विधि का उपयोग करके गुणांक ज्ञात करें बी 0 , बी 1 , बीसमय के साथ बड़े पैमाने पर परिवर्तन की निर्भरता का अनुमान लगाने वाले 2 समीकरण।
6. अनुमानित समीकरण के अनुसार माप की शुरुआत में द्रव्यमान अनुमान की गणना करें
7. सॉर्टिंग का उपयोग करके सन्निकटन परिणामों का विश्लेषण करें और गलत मानों को हटा दें
8. निर्भरता ग्राफ पर सन्निकटन के परिणाम प्रदर्शित करें एम – .
9. सिस्टम और प्रक्रिया की विशेषताओं की गणना करें: एम 0 , 0 , डी /क .
परीक्षा के परिणाम:
एक। सेल "ए1" में - नमूने का सतह क्षेत्र, आसन्न सेल "बी1" में - माप की इकाइयाँ;
बी। सेल "ए2" में - मूल नमूने का द्रव्यमान, सेल "बी2" में - माप की इकाइयाँ;
सी। सेल "ए3" में - प्रयोग का तापमान, सेल "बी3" में - माप की इकाइयाँ;
डी। सेल "ए4" में - कड़ाई से मिश्रित मोड में स्केल परत की मोटाई, सेल "बी4" में - माप की इकाइयाँ;
इ। सेल "ए10" से शुरू करके, कार्य के बारे में निष्कर्ष स्पष्ट रूप से तैयार किया जाना चाहिए।
सेल A6-A7 में स्प्रेडशीट पुस्तक की अन्य शीटों पर मौजूद सेल के संदर्भ होने चाहिए, जिन पर प्रस्तुत परिणाम प्राप्त करने के लिए गणना की गई थी, न कि स्वयं संख्यात्मक मान! यदि यह आवश्यकता पूरी नहीं होती है, तो सत्यापन कार्यक्रम "सूचना प्रस्तुत करने में त्रुटि" संदेश देता है।
2. सही ढंग से डिजाइन किया गया निर्भरता ग्राफ एम- प्रयोगात्मक रूप से (अंक) प्राप्त किए गए और सभी आवश्यक हस्ताक्षरों और नोटेशन के साथ इलेक्ट्रॉनिक तालिकाओं की एक अलग शीट पर एक बहुपद (रेखा) द्वारा अनुमानित किया गया।
प्रश्नों पर नियंत्रण रखें
1. वायु वायुमंडल में उच्च तापमान ऑक्सीकरण के दौरान लोहे पर प्राप्त पैमाने की संरचना क्या है?
2. स्केल में वुस्टाइट चरण की उपस्थिति से लौह ऑक्सीकरण की दर में तेज वृद्धि क्यों होती है?
3. लौह ऑक्सीकरण की विषमांगी प्रक्रिया के चरण क्या हैं?
4. लौह ऑक्सीकरण के प्रसार मोड और गतिज मोड के बीच क्या अंतर है?
5. कार्य को सम्पादित करने की प्रक्रिया एवं कार्यप्रणाली क्या है?
6. ऑक्सीकरण प्रक्रिया के तरीके की पहचान कैसे करें?
2.2 ऑक्साइड पिघलने की विशिष्ट विद्युत चालकता की तापमान निर्भरता का अध्ययन (कार्य संख्या 14)
2.2.1 स्लैग की विद्युत चालकता की प्रकृति के बारे में सामान्य जानकारी
उनकी संरचना और तापमान पर स्लैग की विशिष्ट विद्युत चालकता की निर्भरता का अध्ययन धातु विज्ञान के लिए सैद्धांतिक और अनुप्रयोग दोनों में बहुत महत्वपूर्ण है। विद्युत चालकता का मूल्य स्टील उत्पादन प्रक्रियाओं में धातु और स्लैग के बीच सबसे महत्वपूर्ण प्रतिक्रियाओं की दर पर, धातुकर्म इकाइयों की उत्पादकता पर, विशेष रूप से सिंथेटिक स्लैग को गलाने के लिए इलेक्ट्रोस्लैग प्रौद्योगिकियों या आर्क भट्टियों में महत्वपूर्ण प्रभाव डाल सकता है, जहां की तीव्रता ऊष्मा का निकलना पिघले हुए माध्यम से प्रवाहित विद्युत धारा की मात्रा पर निर्भर करता है। इसके अलावा, विशिष्ट विद्युत चालकता, एक संरचनात्मक रूप से संवेदनशील संपत्ति होने के नाते, पिघलने की संरचना, एकाग्रता और चार्ज कणों के प्रकार के बारे में अप्रत्यक्ष जानकारी प्रदान करती है।
विशेष रूप से प्रोफेसर ओ.ए. एसिन के वैज्ञानिक स्कूल द्वारा तैयार किए गए ऑक्साइड पिघलने की संरचना के बारे में विचारों के अनुसार, उनमें अनावेशित कण मौजूद नहीं हो सकते हैं। साथ ही, पिघले हुए आयन आकार और संरचना में बहुत भिन्न होते हैं। मूल ऑक्साइड तत्व सरल आयनों के रूप में मौजूद होते हैं, उदाहरण के लिए, Na +, Ca 2+, Mg 2+, Fe 2+, O 2-। इसके विपरीत, उच्च संयोजकता वाले तत्व, जो आयन के रूप में अम्लीय (अम्लीय) ऑक्साइड बनाते हैं, जैसे SiO 2, TiO 2, B 2 O 3, में इतना उच्च इलेक्ट्रोस्टैटिक क्षेत्र होता है कि वे पिघल नहीं सकते सरल Si 4+ आयनों की तरह। Ti 4+, B 3+। वे ऑक्सीजन आयनों को अपने इतने करीब लाते हैं कि वे उनके साथ सहसंयोजक बंधन बनाते हैं और जटिल आयनों के रूप में पिघल में मौजूद होते हैं, जिनमें से सबसे सरल हैं, उदाहरण के लिए, SiO 4 4, TiO 4 4-, BO 3 3- , बीओ 4 5-. जटिल आयनों में द्वि- और त्रि-आयामी संरचनाओं में संयोजित होकर अपनी संरचना को जटिल बनाने की क्षमता होती है। उदाहरण के लिए, दो सिलिकॉन-ऑक्सीजन टेट्राहेड्रा (SiO 4 4-) को शीर्ष पर जोड़ा जा सकता है, जिससे सबसे सरल रैखिक श्रृंखला (Si 2 O 7 6-) बनती है। इससे एक ऑक्सीजन आयन निकलता है:
SiO44- + SiO44- = Si2O76- + O2-.
इन मुद्दों को अधिक विस्तार से देखा जा सकता है, उदाहरण के लिए, शैक्षिक साहित्य में।
विद्युतीय प्रतिरोध आरसाधारण रैखिक कंडक्टरों को संबंध से निर्धारित किया जा सकता है
प्रतिरोधकता कहाँ है, एल- लंबाई, एस– कंडक्टर का क्रॉस-सेक्शनल क्षेत्र। मात्रा को पदार्थ की विशिष्ट विद्युत चालकता कहा जाता है। सूत्र (14.1) से यह निम्नानुसार है,
विद्युत चालकता का आयाम ओम-1 मीटर-1 = एस/एम (एस-सीमेंस) में व्यक्त किया जाता है। विशिष्ट विद्युत चालकता 1 मीटर 2 के क्षेत्र वाले और एक दूसरे से 1 मीटर की दूरी पर स्थित दो समानांतर इलेक्ट्रोडों के बीच संलग्न पिघल की मात्रा की विद्युत चालकता की विशेषता है।
अधिक सामान्य मामले (गैर-समान विद्युत क्षेत्र) में, विद्युत चालकता को वर्तमान घनत्व के बीच आनुपातिकता के गुणांक के रूप में परिभाषित किया गया है मैंएक चालक और विद्युत विभव प्रवणता में:
विद्युत चालकता की उपस्थिति विद्युत क्षेत्र के प्रभाव में किसी पदार्थ में आवेशों के स्थानांतरण से जुड़ी होती है। धातुओं में, बिजली के स्थानांतरण में चालन बैंड इलेक्ट्रॉन शामिल होते हैं, जिनकी सांद्रता व्यावहारिक रूप से तापमान से स्वतंत्र होती है। बढ़ते तापमान के साथ, धातुओं की विशिष्ट विद्युत चालकता कम हो जाती है, क्योंकि "मुक्त" इलेक्ट्रॉनों की सांद्रता स्थिर रहती है, और क्रिस्टल जाली के आयनों के थर्मल आंदोलन का उन पर ब्रेकिंग प्रभाव बढ़ जाता है।
अर्धचालकों में, विद्युत आवेश वाहक चालन बैंड में अर्ध-मुक्त इलेक्ट्रॉन होते हैं या वैलेंस ऊर्जा बैंड (इलेक्ट्रॉन छेद) में रिक्तियां होती हैं, जो दाता स्तर से अर्धचालक के चालन बैंड तक इलेक्ट्रॉनों के थर्मल सक्रिय संक्रमण के कारण उत्पन्न होती हैं। बढ़ते तापमान के साथ, ऐसे सक्रिय संक्रमणों की संभावना बढ़ जाती है, और विद्युत प्रवाह वाहक और विद्युत चालकता की एकाग्रता तदनुसार बढ़ जाती है।
इलेक्ट्रोलाइट्स में, जिसमें ऑक्साइड पिघलाव शामिल है, निम्नलिखित आयन, एक नियम के रूप में, बिजली के हस्तांतरण में भाग लेते हैं: Na +, Ca 2+, Mg 2+, SiO 4 4–, BO 2 – और अन्य। प्रत्येक आयन ј -वें प्रकार ज्ञात संबंध के अनुसार विद्युत धारा घनत्व के कुल मूल्य में योगदान कर सकता है
आंशिक विद्युत चालकता कहाँ है; Dј , सीј , z ј– प्रसार गुणांक, आयन की सांद्रता और आवेश ј -वीं कक्षा; एफ– फैराडे स्थिरांक; टी- तापमान; आर
जाहिर है, मात्राओं का योग मैंकुल वर्तमान घनत्व के बराबर मैंसभी आयनों की गति से संबद्ध, और संपूर्ण पिघल की विशिष्ट विद्युत चालकता आंशिक चालकता का योग है।
इलेक्ट्रोलाइट्स में आयनों की गति एक सक्रियण प्रक्रिया है। इसका मतलब यह है कि विद्युत क्षेत्र के प्रभाव में, सभी आयन नहीं चलते हैं, बल्कि केवल सबसे सक्रिय आयन चलते हैं, जिनमें औसत स्तर की तुलना में ऊर्जा की एक निश्चित अधिकता होती है। यह अतिरिक्त ऊर्जा, जिसे विद्युत चालकता की सक्रियण ऊर्जा कहा जाता है, किसी दिए गए आयन की उसके पर्यावरण के साथ बातचीत की ताकतों पर काबू पाने के साथ-साथ एक रिक्ति (गुहा) बनाने के लिए आवश्यक है जिसमें यह गुजरता है। बोल्ट्जमैन के नियम के अनुसार सक्रिय कणों की संख्या बढ़ती है
चरघातांकीय नियम के अनुसार तापमान बढ़ाना। इसीलिए ![]() . स्लेडोवा-
. स्लेडोवा-
इसलिए, (14.5) के अनुसार, विद्युत चालकता की तापमान निर्भरता को घातांक के योग द्वारा वर्णित किया जाना चाहिए। हालाँकि, यह ज्ञात है कि जैसे-जैसे कणों का आकार बढ़ता है, उनकी सक्रियण ऊर्जा भी काफी बढ़ जाती है। इसलिए, संबंध (14.5) में, एक नियम के रूप में, बड़े, कम गतिशीलता वाले आयनों के योगदान की उपेक्षा की जाती है, और बाकी के लिए, आंशिक मान औसत होते हैं।
परिणामस्वरूप, ऑक्साइड पिघलने की विशिष्ट विद्युत चालकता की तापमान निर्भरता निम्नलिखित रूप लेती है:
![]() (14.6)
(14.6)
जो प्रयोगात्मक डेटा के साथ अच्छी तरह मेल खाता है।
ऑक्साइड CaO, SiO 2, MgO, Al 2 O 3 युक्त धातुकर्म स्लैग के विशिष्ट मान लिक्विडस तापमान के पास 0.1 - 1.0 S सेमी -1 की सीमा में हैं, जो तरल धातुओं की विद्युत चालकता से काफी कम है (10) 5-10 7 एस सेमी-1). विद्युत चालकता की सक्रियण ऊर्जा मूल स्लैग में तापमान से लगभग स्वतंत्र होती है, लेकिन उनके डीपोलीमराइजेशन के कारण अम्लीय पिघल में बढ़ते तापमान के साथ थोड़ी कमी आ सकती है। आमतौर पर मान पिघले हुए पदार्थ की संरचना के आधार पर 40-200 kJ/mol की सीमा में होता है।
आयरन ऑक्साइड (FeO, Fe 2 O 3) या अन्य संक्रमण धातु ऑक्साइड (उदाहरण के लिए, MnO, V 2 O 3, Cr 2 O 3) की बढ़ी हुई सामग्री (10% से अधिक) पर, स्लैग की विद्युत चालकता की प्रकृति परिवर्तन, क्योंकि आयनिक चालकता के अलावा उनमें इलेक्ट्रॉनिक चालकता का एक महत्वपूर्ण भाग दिखाई देता है। ऐसे पिघलों में चालकता का इलेक्ट्रॉनिक घटक रिले तंत्र के साथ इलेक्ट्रॉनों या इलेक्ट्रॉन "छेद" की गति के कारण कम वैलेंस वाले एक संक्रमण धातु धनायन से उच्च वैलेंस वाले धनायन तक होता है। आर-इन कणों के बीच स्थित ऑक्सीजन आयन की कक्षाएँ।
Me 2+ – O 2– – Me 3+ के संयोजन में इलेक्ट्रॉनों की बहुत उच्च गतिशीलता, उनकी अपेक्षाकृत कम सांद्रता के बावजूद, स्लैग की विद्युत चालकता को तेजी से बढ़ाती है। इस प्रकार, शुद्ध लोहे के पिघलने के लिए æ का अधिकतम मान FeO – Fe 2 O 3 हो सकता है
10 2 एस सेमी -1, शेष, हालांकि, धातुओं की तुलना में काफी कम है।
2.2.2 स्थापना और माप प्रक्रिया का विवरण
कार्य तापमान सीमा 700 - 800 डिग्री सेल्सियस में पिघले हुए सोडियम टेट्राबोरेट Na 2 O·2B 2 O 3 की विशिष्ट विद्युत चालकता निर्धारित करता है। धातु-इलेक्ट्रोलाइट इंटरफ़ेस प्रतिरोध की उपस्थिति से जुड़ी जटिलताओं को खत्म करने के लिए, विद्युत चालकता का अध्ययन उन परिस्थितियों में किया जाना चाहिए जहां इंटरफ़ेस प्रतिरोध नगण्य है। इसे प्रत्यक्ष धारा के बजाय पर्याप्त उच्च आवृत्ति (≈ 10 kHz) की प्रत्यावर्ती धारा का उपयोग करके प्राप्त किया जा सकता है।
संस्थापन का विद्युत सर्किट आरेख चित्र 2 में दिखाया गया है।

चित्र 2. स्लैग की विद्युत चालकता को मापने के लिए स्थापना का विद्युत सर्किट आरेख:
ZG - ऑडियो आवृत्ति जनरेटर; पीसी - साउंड कार्ड वाला पर्सनल कंप्यूटर; याच समाधान और याच एसएल - इलेक्ट्रोकेमिकल कोशिकाएं जिनमें क्रमशः केसीएल या स्लैग का जलीय घोल होता है; आर फ़्लो - ज्ञात मान का संदर्भ प्रतिरोध।
एक ऑडियो फ़्रीक्वेंसी जनरेटर से प्रत्यावर्ती धारा को स्लैग वाले सेल में आपूर्ति की जाती है और इसके साथ श्रृंखला में जुड़े ज्ञात मूल्य का एक संदर्भ प्रतिरोध होता है। पीसी साउंड कार्ड का उपयोग करके, सेल में वोल्टेज ड्रॉप और संदर्भ प्रतिरोध को मापा जाता है। चूँकि R fl और Yach से प्रवाहित होने वाली धारा समान है
![]() (14.7)
(14.7)
प्रयोगशाला स्थापना रखरखाव कार्यक्रम एक फ़ाइल में अनुपात मान की गणना, प्रदर्शित और लिखता है ( आर) ध्वनि जनरेटर के आउटपुट पर प्रत्यावर्ती धारा के आयाम मान ( यू zg) और मापने वाले सेल पर ( यूकक्ष):
 इसे जानकर आप सेल प्रतिरोध निर्धारित कर सकते हैं
इसे जानकर आप सेल प्रतिरोध निर्धारित कर सकते हैं
कोशिका स्थिरांक कहां है.
निर्धारण हेतु कप्रयोगात्मक सेटअप में सेल, एक सहायक सेल का उपयोग किया जाता है, जो कि ज्यामितीय मापदंडों के संदर्भ में अध्ययन किया जा रहा है। दोनों इलेक्ट्रोकेमिकल सेल एक इलेक्ट्रोलाइट के साथ कोरन्डम नावें हैं। उनमें समान क्रॉस-सेक्शन और लंबाई के दो बेलनाकार धातु इलेक्ट्रोड होते हैं, जो एक स्थिर अनुपात (एल/एस) प्रभाव सुनिश्चित करने के लिए एक दूसरे से समान दूरी पर स्थित होते हैं।
अध्ययनाधीन सेल में Na 2 O · 2B 2 O 3 का पिघल होता है और इसे 700 - 800 डिग्री सेल्सियस के तापमान पर हीटिंग भट्टी में रखा जाता है। सहायक सेल कमरे के तापमान पर है और KCl के 0.1 N जलीय घोल से भरा है, जिसकी विद्युत चालकता 0.0112 S सेमी -1 है। समाधान की विद्युत चालकता को जानना और विद्युत प्रतिरोध का निर्धारण करना (सूत्र 14.9 देखें)।
 सहायक कोशिका (
सहायक कोशिका (
2.2.3 कार्य आदेश
A. वास्तविक समय मापने की प्रणाली का उपयोग करके संचालन
माप शुरू करने से पहले, ओवन को 850 डिग्री सेल्सियस के तापमान तक गर्म किया जाना चाहिए। स्थापना प्रक्रिया इस प्रकार है:
1. मॉनिटर स्क्रीन पर दिए गए निर्देशों के अनुसार आरंभीकरण प्रक्रिया पूरी करने के बाद, ओवन बंद करें, "1 - संदर्भ प्रतिरोध" स्विच को "1 - हाय" स्थिति पर सेट करें और आगे के निर्देशों का पालन करें।
2. संकेत "स्विच 2 - "समाधान" स्थिति पर" प्रकट होने के बाद, आपको इसका पालन करना चाहिए और जब तक संकेत "स्विच 2 - 'एमईएलटी' स्थिति पर" प्रकट नहीं होता है, तब तक दिखाई देने वाले प्रतिरोध अनुपात मानों को रिकॉर्ड करें हर 5 सेकंड में.
3. दूसरे निर्देश का पालन करें और तापमान परिवर्तन की निगरानी करें। जैसे ही तापमान 800 डिग्री सेल्सियस से नीचे चला जाता है, ग्राफ़ डिस्प्ले चालू करने के लिए "एक्सएस" कीबोर्ड कमांड का उपयोग करें और हर 5 सेकंड में तापमान मान और प्रतिरोध अनुपात रिकॉर्ड करें।
4. मेल्ट को 650 डिग्री सेल्सियस से नीचे के तापमान तक ठंडा करने के बाद, इस इंस्टॉलेशन पर काम करने वाले दूसरे छात्र के लिए माप शुरू किया जाना चाहिए। स्विच "1 - संदर्भ प्रतिरोध" को "2 - लो" स्थिति पर सेट करें और उस क्षण से दूसरा छात्र हर 5 सेकंड में तापमान मान और प्रतिरोध अनुपात रिकॉर्ड करना शुरू कर देता है।
5. जब पिघल को 500 डिग्री सेल्सियस के तापमान तक ठंडा किया जाता है या प्रतिरोध अनुपात 6 के करीब मान तक पहुंच जाता है, तो कीबोर्ड से "Xe" कमांड जारी करके माप बंद कर दिया जाना चाहिए। इस क्षण से, दूसरे छात्र को स्विच 2 को 'समाधान' स्थिति में ले जाना होगा और दस प्रतिरोध अनुपात मान लिखना होगा।
B. किसी फ़ाइल में पहले लिखे गए डेटा के साथ कार्य करना
प्रोग्राम को सक्रिय करने के बाद, संदर्भ प्रतिरोध के मूल्य के बारे में एक संदेश स्क्रीन पर दिखाई देता है और कई प्रतिरोध अनुपात मान क्रमिक रूप से प्रदर्शित होते हैं ( आर) अंशांकन सेल। औसत के बाद, ये डेटा आपको इंस्टॉलेशन स्थिरांक खोजने की अनुमति देगा।
इसके बाद, हर कुछ सेकंड में मापने वाले सेल के लिए तापमान और प्रतिरोध अनुपात मान स्क्रीन पर दिखाई देते हैं। यह जानकारी एक ग्राफ़ पर प्रदर्शित होती है.
प्रोग्राम स्वचालित रूप से बंद हो जाता है और सभी परिणाम शिक्षक के पीसी पर भेज देता है।
2.2.4 माप परिणामों का प्रसंस्करण और प्रस्तुति
माप परिणामों के आधार पर, आपको निम्नलिखित शीर्षक वाली एक तालिका भरनी चाहिए:
तालिका 1. Na 2 O 2B 2 O 3 पिघल की विद्युत चालकता की तापमान निर्भरता
किसी तालिका में, डेटा फ़ाइल खोले जाने पर पहले दो कॉलम भरे जाते हैं, और बाकी की गणना की जाती है। उनका उपयोग करके, आपको निर्भरता ln() - 10 3 /T को प्लॉट करना चाहिए और सक्रियण ऊर्जा का मूल्य निर्धारित करने के लिए कम से कम वर्ग विधि (OpenOffice.calc में LINEST फ़ंक्शन) का उपयोग करना चाहिए। ग्राफ़ पर एक अनुमानित सीधी रेखा दिखाई जानी चाहिए। आपको विद्युत चालकता बनाम तापमान का एक ग्राफ भी बनाना चाहिए। परिणामों को संसाधित करने की प्रक्रिया
1. माप परिणामों के रिकॉर्ड को एक स्प्रेडशीट फ़ाइल में दर्ज करें।
2. अंशांकन सेल के लिए औसत प्रतिरोध अनुपात की गणना करें।
3. संस्थापन स्थिरांक की गणना करें.
4. निर्भरता ग्राफ बनाएं आर – टी, बाहरी मूल्यों को दृष्टिगत रूप से पहचानें और हटाएं। यदि उनकी संख्या बड़ी है तो छँटाई का उपयोग करें।
5. मापने वाले सेल के प्रतिरोध, विभिन्न तापमानों पर पिघले ऑक्साइड की विद्युत चालकता, विद्युत चालकता का लघुगणक और व्युत्क्रम निरपेक्ष तापमान की गणना करें
बी 0 , बीउलटे तापमान पर विद्युत चालकता के लघुगणक की निर्भरता का अनुमान लगाने वाले समीकरण का 1, और सक्रियण ऊर्जा की गणना करें।
7. व्युत्क्रम तापमान पर विद्युत चालकता के लघुगणक की निर्भरता का एक ग्राफ एक अलग शीट पर बनाएं और एक अनुमानित निर्भरता दें परीक्षा के परिणाम:
1. समीक्षा के लिए प्रस्तुत स्प्रेडशीट पुस्तक में, "परिणाम" शीर्षक वाले पहले पृष्ठ में निम्नलिखित जानकारी होनी चाहिए:
एक। सेल "ए1" में - प्रारंभिक तापमान, सेल "बी1" में - माप की इकाइयाँ;
सी। सेल "ए3" में - विद्युत चालकता की सक्रियण ऊर्जा, सेल "बी3" में - माप की इकाइयाँ;
डी। सेल "ए4" में - विद्युत चालकता की तापमान निर्भरता के सूत्र में पूर्व-घातीय कारक, सेल "बी4" में - माप की इकाइयाँ;
इ। सेल "ए5" से शुरू करके, कार्य के बारे में निष्कर्ष स्पष्ट रूप से तैयार किया जाना चाहिए।
कक्ष A1-A4 में स्प्रेडशीट पुस्तक की अन्य शीटों पर कक्षों के संदर्भ शामिल होने चाहिए, जिन पर प्रस्तुत परिणाम प्राप्त करने के लिए गणना की गई थी, न कि स्वयं संख्यात्मक मान! यदि यह आवश्यकता पूरी नहीं होती है, तो सत्यापन कार्यक्रम "सूचना प्रस्तुत करने में त्रुटि" संदेश देता है।
2. सभी आवश्यक हस्ताक्षरों और नोटेशन के साथ स्प्रेडशीट की एक अलग शीट पर, प्रयोगात्मक डेटा (बिंदु) से प्राप्त और बहुपद (रेखा) द्वारा अनुमानित व्युत्क्रम तापमान पर विद्युत चालकता के लघुगणक की निर्भरता का एक सही ढंग से डिज़ाइन किया गया ग्राफ।
प्रश्नों पर नियंत्रण रखें
1. विद्युत चालकता किसे कहते हैं?
2. कौन से कण स्लैग की विद्युत चालकता निर्धारित करते हैं?
3. धातुओं और ऑक्साइड के पिघलने की विद्युत चालकता की तापमान निर्भरता की प्रकृति क्या है?
4. कोशिका स्थिरांक किस पर निर्भर करता है और इसे कैसे निर्धारित किया जाए?
5. आपको निर्धारण के लिए प्रत्यावर्ती धारा का उपयोग करने की आवश्यकता क्यों है?
6. विद्युत चालकता की सक्रियण ऊर्जा तापमान पर कैसे निर्भर करती है?
7. प्रयोगशाला सेटअप में कौन से सेंसर और उपकरण का उपयोग किया जाता है। वे किन भौतिक राशियों को पंजीकृत करने की अनुमति देते हैं?
8. कार्य के परिणामों के आधार पर कौन से ग्राफ़ (किस निर्देशांक में) प्रस्तुत किए जाने चाहिए?
9. प्राथमिक डेटा को संसाधित करने के बाद कौन सी भौतिक रासायनिक मात्रा प्राप्त की जानी चाहिए?
10. तय करें कि प्रयोग से पहले क्या माप लिया जाता है, प्रयोग के दौरान कौन से मान दर्ज किए जाते हैं, कौन सा डेटा प्राथमिक जानकारी से संबंधित है, यह किस प्रसंस्करण से गुजरता है और कौन सी जानकारी प्राप्त की जाती है।
2.3 एक सिमुलेशन मॉडल पर स्लैग द्वारा धातु डीसल्फराइजेशन की गतिशीलता का अध्ययन (कार्य संख्या 15)
2.3.1 स्लैग द्वारा धातु डीसल्फराइजेशन की गतिशीलता के बारे में सामान्य जानकारी
स्टील में सल्फर की अशुद्धियाँ, 0.005 wt से अधिक मात्रा में। %, इसके यांत्रिक, विद्युत, संक्षारण-रोधी और अन्य गुणों को महत्वपूर्ण रूप से कम कर देता है, धातु की वेल्डेबिलिटी को ख़राब कर देता है, और लालिमा और ठंडी भंगुरता की उपस्थिति का कारण बनता है। इसलिए, स्टील डीसल्फराइजेशन की प्रक्रिया, जो विशेष रूप से स्लैग के साथ प्रभावी ढंग से होती है, उच्च गुणवत्ता वाले धातु विज्ञान के लिए बहुत महत्वपूर्ण है।
डीसल्फराइजेशन दर के प्रभावी नियंत्रण के लिए प्रतिक्रिया के गतिज नियमों का अध्ययन, इसके तंत्र और घटना के तरीके की पहचान करना आवश्यक है, क्योंकि धातुकर्म इकाइयों की वास्तविक स्थितियों में, धातु और स्लैग के बीच सल्फर का संतुलन वितरण आमतौर पर हासिल नहीं किया जाता है।
स्टील में अधिकांश अन्य अशुद्धियों के विपरीत, धातु से स्लैग में सल्फर का संक्रमण एक कम करने वाली प्रक्रिया है, ऑक्सीडेटिव नहीं। [एस] +2ई = (एस 2-)।
इसका मतलब यह है कि कैथोडिक प्रक्रिया की निरंतर घटना के लिए, जिससे धातु पर सकारात्मक चार्ज का संचय होता है, धातु चरण में इलेक्ट्रॉनों को दान करने में सक्षम अन्य कणों का एक साथ संक्रमण आवश्यक है। इस तरह की सहवर्ती एनोडिक प्रक्रियाएं स्टील की संरचना के आधार पर स्लैग ऑक्सीजन आयनों या लौह, कार्बन, मैंगनीज, सिलिकॉन और अन्य धातु अशुद्धियों के कणों का ऑक्सीकरण हो सकती हैं।
2. (ओ 2–) = [ओ] + 2ई,
3. = (Fe 2+) + 2e,
4. [सी] + (ओ 2-) = सीओ + 2ई, 5. = (एमएन 2+) +2ई।
कैथोडिक और किसी एक एनोडिक प्रक्रिया को एक साथ लेने पर, हमें डिसल्फराइजेशन प्रतिक्रिया के स्टोइकोमेट्रिक समीकरण को निम्नलिखित रूप में लिखने की अनुमति मिलती है, उदाहरण के लिए:
1-2. (CaO) + [S] = (CaS) + [O], H = -240 kJ/mol
1-3. + [एस] +(सीएओ)= (FeO) + (CaS)। एच = -485 केजे/मोल
संतुलन स्थिरांक के लिए संगत अभिव्यक्तियों का रूप होता है
 (15.1)
(15.1)
जाहिर है, एक उदाहरण के रूप में चुनी गई प्रक्रियाएं और समान प्रक्रियाएं एक साथ हो सकती हैं। संबंध (15.1) से यह पता चलता है कि स्थिर तापमान पर धातु डीसल्फराइजेशन की डिग्री, यानी। संतुलन स्थिरांक का स्थिर मान, ऑक्साइड पिघल में मुक्त ऑक्सीजन आयन (O 2-) की बढ़ती सांद्रता के साथ बढ़ता है। दरअसल, संतुलन स्थिरांक के अपरिवर्तित मूल्य के अनुरूप होने के लिए हर में कारक में वृद्धि की भरपाई अन्य कारक में कमी से की जानी चाहिए। ध्यान दें कि अत्यधिक बुनियादी, कैल्शियम ऑक्साइड युक्त स्लैग का उपयोग करने पर मुक्त ऑक्सीजन आयनों की सामग्री बढ़ जाती है। संबंध (15.2) का विश्लेषण करके हम यह निष्कर्ष निकाल सकते हैं कि ऑक्साइड पिघल में लौह आयनों (Fe 2+) की सामग्री न्यूनतम होनी चाहिए, अर्थात। स्लैग में न्यूनतम मात्रा में आयरन ऑक्साइड होना चाहिए। धातु में डीऑक्सीडाइज़र (एमएन, सी, अल, सी) की उपस्थिति भी (Fe 2+) और [O] सामग्री को कम करके स्टील डिसल्फराइजेशन की पूर्णता को बढ़ाती है।
प्रतिक्रिया 1-2 गर्मी अवशोषण (∆H>0) के साथ होती है, इसलिए, जैसे-जैसे प्रक्रिया आगे बढ़ेगी, धातुकर्म इकाई में तापमान कम हो जाएगा। इसके विपरीत, प्रतिक्रिया 1-3 के साथ ऊष्मा (∆H) निकलती है<0) и, если она имеет определяющее значение, температура в агрегате будет повышаться.
डीसल्फराइजेशन का गतिशील रूप से वर्णन करते समय, प्रक्रिया के निम्नलिखित चरणों पर विचार किया जाना चाहिए:
धातु की मात्रा से स्लैग के साथ सीमा तक सल्फर कणों की डिलीवरी, पहले संवहन प्रसार द्वारा महसूस की गई, और सीधे आणविक प्रसार द्वारा धातु-स्लैग इंटरफ़ेस के पास; सल्फर परमाणुओं में इलेक्ट्रॉन जोड़ने और एस 2- आयनों के निर्माण का विद्युत रासायनिक कार्य; जो एक सोखना-रासायनिक क्रिया है, आणविक और फिर संवहन प्रसार के कारण स्लैग मात्रा में सल्फर आयनों को हटाना।
Fe, Mn, Si परमाणुओं या O 2- आयनों की भागीदारी के साथ, समान चरण एनोडिक चरणों की विशेषता हैं। प्रत्येक चरण डिसल्फराइजेशन प्रक्रिया के समग्र प्रतिरोध में योगदान देता है। कई संकेतित प्रतिरोधों के माध्यम से कणों के प्रवाह के लिए प्रेरक बल नोइक्विलिब्रियम धातु-स्लैग प्रणाली में उनकी विद्युत रासायनिक क्षमता में अंतर या चरण इंटरफ़ेस पर वास्तविक और संतुलन इलेक्ट्रोड क्षमता के बीच आनुपातिक अंतर है, जिसे कहा जाता है वोल्टेज से अधिक .
कई क्रमिक चरणों वाली प्रक्रिया की गति उच्चतम प्रतिरोध वाले चरण के योगदान से निर्धारित होती है - सीमितअवस्था। दर-सीमित चरण के तंत्र के आधार पर, कोई प्रसार या गतिज प्रतिक्रिया मोड की बात करता है। यदि घटना के विभिन्न तंत्रों वाले चरणों में तुलनीय प्रतिरोध होता है, तो हम मिश्रित प्रतिक्रिया मोड की बात करते हैं। प्रत्येक चरण का प्रतिरोध महत्वपूर्ण रूप से सिस्टम की प्रकृति और गुणों, अभिकर्मकों की एकाग्रता, चरण मिश्रण की तीव्रता और तापमान पर निर्भर करता है। उदाहरण के लिए, सल्फर कमी की विद्युत रासायनिक क्रिया की दर विनिमय धारा के परिमाण से निर्धारित होती है
![]() (15.3)
(15.3)
कहाँ में- तापमान का कार्य, सी[रेत सी(एस 2-) - धातु और धातुमल में सल्फर की सांद्रता, α - स्थानांतरण गुणांक।
चरण सीमा तक सल्फर वितरण की गति इन कणों के सीमित प्रसार प्रवाह द्वारा निर्धारित की जाती है
कहाँ डी[एस] सल्फर प्रसार गुणांक है, β संवहन स्थिरांक है, जो पिघल में संवहन की तीव्रता से निर्धारित होता है, यह तरल में संवहन प्रवाह की रैखिक गति के वर्गमूल के समानुपाती होता है।
उपलब्ध प्रायोगिक डेटा से संकेत मिलता है कि पिघल संवहन की सामान्य परिस्थितियों में, सल्फर आयनों के निर्वहन का विद्युत रासायनिक कार्य अपेक्षाकृत तेज़ी से होता है, अर्थात। डीसल्फराइजेशन मुख्य रूप से धातु या स्लैग में कणों के प्रसार से बाधित होता है। हालाँकि, धातु में सल्फर सांद्रता बढ़ने से, प्रसार कठिनाइयाँ कम हो जाती हैं और प्रक्रिया मोड गतिज में बदल सकता है। यह लोहे में कार्बन के जुड़ने से भी सुगम होता है, क्योंकि कार्बन धातु-स्लैग सीमा पर ऑक्सीजन आयनों का निर्वहन महत्वपूर्ण गतिज अवरोध के साथ होता है।
यह ध्यान में रखा जाना चाहिए कि इलेक्ट्रोलाइट्स के साथ धातुओं की बातचीत के बारे में इलेक्ट्रोकेमिकल विचार प्रक्रियाओं के तंत्र को स्पष्ट करना और होने वाली घटनाओं को विस्तार से समझना संभव बनाते हैं। साथ ही, औपचारिक गतिकी के सरल समीकरण पूरी तरह से अपनी वैधता बनाए रखते हैं। विशेष रूप से, महत्वपूर्ण त्रुटियों के साथ प्राप्त प्रयोगात्मक परिणामों के मोटे विश्लेषण के लिए, प्रतिक्रिया दर 1-3 के समीकरण को इसके सरलतम रूप में लिखा जा सकता है:
कहाँ कएफ और कआर - आगे और पीछे की प्रतिक्रियाओं की दर स्थिरांक। यह संबंध तब संतुष्ट होता है जब लोहे में सल्फर और स्लैग में कैल्शियम सल्फाइड और वुस्टाइट के घोल को असीम रूप से पतला माना जा सकता है और इन अभिकर्मकों के लिए प्रतिक्रिया आदेश एकता के करीब हैं। विचाराधीन प्रतिक्रिया में शेष अभिकर्मकों की सामग्री इतनी अधिक है कि संपूर्ण अंतःक्रिया का समय व्यावहारिक रूप से स्थिर रहता है और उनकी सांद्रता को स्थिरांक में शामिल किया जा सकता है कएफ और कआर
दूसरी ओर, यदि डिसल्फराइजेशन प्रक्रिया संतुलन से दूर है, तो रिवर्स प्रतिक्रिया की दर को नजरअंदाज किया जा सकता है। फिर डीसल्फराइजेशन की दर धातु में सल्फर सांद्रता के समानुपाती होनी चाहिए। प्रयोगात्मक डेटा के विवरण के इस संस्करण को डिसल्फराइजेशन दर के लघुगणक और धातु में सल्फर एकाग्रता के लघुगणक के बीच संबंध की जांच करके सत्यापित किया जा सकता है। यदि यह संबंध रैखिक है, और निर्भरता का कोणीय गुणांक एकता के करीब होना चाहिए, तो यह प्रक्रिया के प्रसार मोड के पक्ष में एक तर्क है।
2.3.2 प्रक्रिया का गणितीय मॉडल
कई एनोडिक चरणों की संभावना कई अशुद्धियों वाले स्टील के डीसल्फराइजेशन की प्रक्रियाओं के गणितीय विवरण को बहुत जटिल बनाती है। इस संबंध में, मॉडल में कुछ सरलीकरण पेश किए गए; विशेष रूप से, पृथक्करण में गतिज कठिनाइयों की उपेक्षा की गई।
लोहे और ऑक्सीजन के संक्रमण की आधी-प्रतिक्रियाओं के लिए, प्रसार नियंत्रण पर स्वीकृत सीमा के संबंध में, रिश्ते बहुत सरल दिखते हैं:
 (15.7)
(15.7)
विद्युत तटस्थता की स्थिति के अनुसार, किसी बाहरी स्रोत से करंट की अनुपस्थिति में, व्यक्तिगत इलेक्ट्रोड अर्ध-प्रतिक्रियाओं के लिए धाराओं के बीच संबंध एक साधारण संबंध द्वारा व्यक्त किया जाता है:
 इलेक्ट्रोड ओवरवॉल्टेज में अंतर () प्रतिक्रियाओं 1-2 और 1-3 के लिए गतिविधियों और संतुलन स्थिरांक के संबंधित उत्पादों के अनुपात द्वारा निर्धारित किया जाता है:
इलेक्ट्रोड ओवरवॉल्टेज में अंतर () प्रतिक्रियाओं 1-2 और 1-3 के लिए गतिविधियों और संतुलन स्थिरांक के संबंधित उत्पादों के अनुपात द्वारा निर्धारित किया जाता है:
समय के संबंध में धातु में सल्फर सांद्रता का व्युत्पन्न समीकरण के अनुसार पहले इलेक्ट्रोड अर्ध-प्रतिक्रिया के वर्तमान द्वारा निर्धारित किया जाता है:
![]() (15.12)
(15.12)
यहाँ मैं 1 , मैं 2 - इलेक्ट्रोड प्रक्रियाओं की वर्तमान घनत्व, η 1, η 2 - उनका ध्रुवीकरण, मैंएन - कण प्रसार धाराओं को सीमित करना ј किसी प्रकार का, मैंओ - गतिज चरण का विनिमय वर्तमान, सी[एस] - धातु में सल्फर एकाग्रता, α - स्थानांतरण गुणांक, पी, कपी गतिविधियों का उत्पाद है और डीसल्फराइजेशन प्रतिक्रिया का संतुलन स्थिरांक है, एस- धातु-स्लैग इंटरफ़ेस का क्षेत्र, वीमैं- धातु का आयतन, टी- तापमान, एफ– फैराडे स्थिरांक, आर- सार्वभौमिक गैस स्थिरांक.
इलेक्ट्रोकेमिकल कैनेटीक्स के नियमों के अनुसार, अभिव्यक्ति (15.6) स्लैग में लौह आयनों के प्रसार के निषेध को ध्यान में रखती है, क्योंकि प्रयोगात्मक डेटा के आधार पर, इन कणों के निर्वहन-आयनीकरण का चरण सीमित नहीं है। अभिव्यक्ति (15.5) स्लैग और धातु में सल्फर कणों के प्रसार की मंदता है, साथ ही इंटरफ़ेस पर सल्फर आयनीकरण की मंदता है।
अभिव्यक्तियों (15.6 - 15.12) को मिलाकर, संख्यात्मक तरीकों का उपयोग करके, चयनित स्थितियों के लिए समय पर धातु में सल्फर एकाग्रता की निर्भरता प्राप्त करना संभव है।
मॉडल निम्नलिखित मापदंडों का उपयोग करता है:
3)  सल्फर आयन विनिमय धारा:
सल्फर आयन विनिमय धारा:
4) डिसल्फराइजेशन प्रतिक्रिया का संतुलन स्थिरांक ( कोआर):
![]()
5) इंटरफ़ेज़ सीमा के क्षेत्र का धातु के आयतन से अनुपात

7) संवहन स्थिरांक (β):
मॉडल डीसल्फराइजेशन की दर और पूर्णता पर सूचीबद्ध कारकों के प्रभाव का विश्लेषण करना संभव बनाता है, साथ ही प्रक्रिया के समग्र प्रतिरोध में प्रसार और गतिज निषेध के योगदान का मूल्यांकन करना संभव बनाता है।
2.3.3 कार्य प्रक्रिया
सिमुलेशन प्रोग्राम द्वारा उत्पन्न छवि चित्र में दिखाई गई है। . पैनल के शीर्ष पर मापी गई मात्राओं के संख्यात्मक मान चुने गए हैं; ग्राफ़ प्रक्रिया सिमुलेशन के दौरान प्राप्त सभी मान प्रदर्शित करता है। धातु और स्लैग पिघलने के घटकों के पदनाम में, धातुकर्म विषयों पर साहित्य में स्वीकृत अतिरिक्त प्रतीकों का उपयोग किया जाता है। वर्गाकार कोष्ठक इंगित करते हैं कि घटक धातु पिघल से संबंधित है, और गोल कोष्ठक इंगित करते हैं कि घटक स्लैग पिघल से संबंधित है। घटक पदनामों में गुणक का उपयोग केवल प्लॉटिंग उद्देश्यों के लिए किया जाता है और मूल्यों की व्याख्या करते समय इसे ध्यान में नहीं रखा जाना चाहिए। मॉडल के संचालन के दौरान, किसी भी समय केवल मापी गई मात्राओं में से एक का मूल्य प्रदर्शित होता है। 6 सेकंड के बाद यह गायब हो जाता है और अगला मान प्रकट होता है। इस अवधि के दौरान, आपके पास अगला मान लिखने के लिए समय होना चाहिए। समय बचाने के लिए, यह अनुशंसा की जाती है कि स्थिर संख्याएँ न लिखें, उदाहरण के लिए, तापमान मान में अग्रणी इकाई।

इंस्टॉलेशन पैनल के ऊपरी दाएं कोने में घड़ी द्वारा माप शुरू होने के पांच मिनट बाद, कुंजी और [नहीं], जहां नो इंस्टॉलेशन नंबर है, को एक साथ दबाकर, चरण मिश्रण की गति को तेज करें।
2.3.4 माप परिणामों का प्रसंस्करण और प्रस्तुति
सिमुलेशन प्रोग्राम द्वारा उत्पन्न माप परिणामों की तालिका को निम्नलिखित गणना कॉलमों के साथ पूरक किया जाना चाहिए:
तालिका 1. प्रयोगात्मक डेटा के सांख्यिकीय प्रसंस्करण के परिणाम
पहले कॉलम की तालिका में आपको प्रक्रिया की शुरुआत से लेकर अब तक के समय की गणना मिनटों में करनी चाहिए।
ग्राफिकल निर्माण के बाद आगे की प्रक्रिया की जाती है - प्रसंस्करण के पहले चरण में, तापमान बनाम समय का एक ग्राफ तैयार किया जाना चाहिए और डेटा की सीमा का आकलन किया जाना चाहिए जब सल्फर संक्रमण मुख्य रूप से लौह संक्रमण के साथ होता है। इस श्रेणी में, समान मिश्रण दर वाले दो क्षेत्रों की पहचान की जाती है और न्यूनतम वर्ग विधि का उपयोग करके फॉर्म के अनुमानित बहुपद के गुणांक पाए जाते हैं:
जो निर्दिष्ट शर्तों के तहत समीकरण (15.5) से अनुसरण करता है। गुणांक के प्राप्त मूल्यों की तुलना करके, प्रक्रिया मोड और संतुलन स्थिति के लिए सिस्टम के दृष्टिकोण की डिग्री के बारे में निष्कर्ष निकाले जाते हैं। ध्यान दें कि समीकरण (15.13) में कोई डमी पद नहीं है।
प्रयोग के परिणामों को स्पष्ट करने के लिए, समय पर सल्फर सांद्रता की निर्भरता और स्लैग में कैल्शियम सल्फाइड की सांद्रता पर डीसल्फराइजेशन दर की निर्भरता का आलेख बनाएं।
परिणामों को संसाधित करने की प्रक्रिया
2. धातु में सल्फर सांद्रता, दर के लघुगणक और सल्फर सांद्रता से डीसल्फराइजेशन प्रक्रिया की दर की गणना करें।
3. इकाई में तापमान बनाम समय, स्लैग द्रव्यमान बनाम समय, डीसल्फराइजेशन दर बनाम समय, और डीसल्फराइजेशन दर का लघुगणक बनाम सल्फर एकाग्रता के लघुगणक के अलग-अलग शीट पर ग्राफ बनाएं।
4. न्यूनतम वर्ग विधि का उपयोग करते हुए, अलग-अलग मिश्रण गति के लिए समीकरण () के अनुसार डीसल्फराइजेशन प्रक्रिया की गतिज विशेषताओं और सल्फर एकाग्रता के संदर्भ में प्रतिक्रिया के क्रम का अलग-अलग अनुमान लगाएं।
परीक्षा के परिणाम:
1. सभी आवश्यक हस्ताक्षरों और प्रतीकों के साथ स्प्रेडशीट की एक अलग शीट पर डीसल्फराइजेशन प्रक्रिया की दर और समय पर इस मूल्य के लघुगणक की निर्भरता के सही ढंग से डिजाइन किए गए ग्राफ।
2. प्रक्रिया के सभी प्रकारों में डीसल्फराइजेशन प्रक्रिया की गतिज विशेषताओं का मान, आयाम (और त्रुटियों) को दर्शाता है।
3. कार्य पर निष्कर्ष.
प्रश्नों पर नियंत्रण रखें
1. स्लैग द्वारा धातु के सबसे पूर्ण डीसल्फराइजेशन के लिए कौन सी स्थितियाँ आवश्यक हैं?
2. सल्फर को हटाने के साथ कौन सी एनोडिक प्रक्रियाएं हो सकती हैं?
3. इंटरफ़ेज़ सीमा से गुजरने वाली सल्फर की प्रक्रिया के चरण क्या हैं?
4. किन मामलों में डीसल्फराइजेशन का प्रसार या गतिज मोड साकार होता है?
5. कार्य का क्रम क्या है?
2.4 प्राकृतिक कार्बोनेट की पृथक्करण प्रक्रियाओं का थर्मोग्राफिक अध्ययन (कार्य संख्या 16)
2.4.1 कार्बोनेट पृथक्करण के सामान्य पैटर्न
थर्मोग्राम किसी नमूने के तापमान की समय पर निर्भरता है। पदार्थों के थर्मल अपघटन की प्रक्रियाओं का अध्ययन करने के लिए थर्मोग्राफिक विधि ऐसी निर्भरता की विशिष्ट विशेषताओं की खोज के बाद व्यापक हो गई है: "तापमान रुक जाता है" और "ढलान तापमान पठार"।
 1.4
1.4
चित्र 3. थर्मोग्राम का चित्रण:
बिंदीदार वक्र एक काल्पनिक तुलना नमूने का थर्मोग्राम है जिसमें पृथक्करण नहीं होता है; ठोस रेखा - दो-चरण पृथक्करण के साथ वास्तविक नमूना।
ये निर्भरता के विशिष्ट खंड हैं, जिसके भीतर कुछ समय () के लिए तापमान या तो स्थिर रहता है (टी = स्थिरांक) या स्थिर दर (टी/) पर थोड़ी मात्रा (टी) से बढ़ता है। संख्यात्मक या ग्राफ़िक विभेदन का उपयोग करके, तापमान रुकने की शुरुआत और अंत के समय और तापमान के क्षणों को अच्छी सटीकता के साथ निर्धारित करना संभव है।
प्रस्तावित प्रयोगशाला कार्य में, प्राकृतिक सामग्री कैल्साइट को लगातार गर्म करके ऐसी निर्भरता प्राप्त की जाती है, जिसका मुख्य घटक कैल्शियम कार्बोनेट है। मुख्य रूप से कैल्साइट से बनी चट्टान को चूना पत्थर कहा जाता है। धातुकर्म में चूना पत्थर का उपयोग बड़ी मात्रा में किया जाता है।
एंडोथर्मिक प्रतिक्रिया द्वारा चूना पत्थर के फायरिंग (गर्मी उपचार) के परिणामस्वरूप
CaCO 3 = CaO + CO 2
चूना (CaO) प्राप्त होता है - स्लैग पिघलने का एक आवश्यक घटक। यह प्रक्रिया चूना पत्थर और चूने दोनों के गलनांक से नीचे के तापमान पर की जाती है। यह ज्ञात है कि कार्बोनेट और उनसे बनने वाले ऑक्साइड परस्पर व्यावहारिक रूप से अघुलनशील होते हैं, इसलिए प्रतिक्रिया उत्पाद एक नया ठोस चरण और गैस है। सामान्य स्थिति में, संतुलन स्थिरांक की अभिव्यक्ति का रूप इस प्रकार है:
यहाँ ए- ठोस अभिकर्मकों की गतिविधि, - गैसीय प्रतिक्रिया उत्पाद का आंशिक दबाव। डोलोमाइट नामक एक अन्य चट्टान का भी धातु विज्ञान में व्यापक रूप से उपयोग किया जाता है। इसमें मुख्य रूप से इसी नाम का एक खनिज होता है, जो कार्बोनिक एसिड CaMg(CO 3) 2 का दोहरा नमक है।
कैल्साइट, किसी भी प्राकृतिक खनिज की तरह, मुख्य घटक के साथ-साथ इसमें विभिन्न अशुद्धियाँ होती हैं, जिनकी मात्रा और संरचना प्राकृतिक संसाधन के जमाव और यहां तक कि विशिष्ट खनन स्थल पर भी निर्भर करती है। अशुद्धता यौगिकों की विविधता इतनी अधिक है कि उन्हें कुछ विशेषताओं के अनुसार वर्गीकृत करना आवश्यक है जो किसी विशेष मामले में महत्वपूर्ण हैं। थर्मोडायनामिक विश्लेषण के लिए, एक आवश्यक विशेषता अभिकर्मकों के साथ समाधान बनाने की अशुद्धियों की क्षमता है। हम मान लेंगे कि खनिज में कोई अशुद्धियाँ नहीं हैं, जो अध्ययन की गई स्थितियों (दबाव और तापमान) की सीमा में, एक दूसरे के साथ या मुख्य घटक या उसके अपघटन उत्पाद के साथ किसी भी रासायनिक प्रतिक्रिया में प्रवेश करती हैं। व्यवहार में, इस स्थिति को सख्ती से पूरा नहीं किया जाता है, क्योंकि उदाहरण के लिए, कैल्साइट में अन्य धातुओं के कार्बोनेट हो सकते हैं, लेकिन आगे के विश्लेषण के दृष्टिकोण से, इन प्रतिक्रियाओं को ध्यान में रखने से नई जानकारी नहीं मिलेगी, लेकिन विश्लेषण अनावश्यक रूप से जटिल हो जाएगा। .
अन्य सभी अशुद्धियों को तीन समूहों में विभाजित किया जा सकता है:
1. अशुद्धियाँ जो कैल्शियम कार्बोनेट के साथ घोल बनाती हैं। ऐसी अशुद्धियों को, निश्चित रूप से, थर्मोडायनामिक विश्लेषण के दौरान और, सबसे अधिक संभावना है, प्रक्रिया के गतिज विश्लेषण के दौरान ध्यान में रखा जाना चाहिए।
2. प्रतिक्रिया उत्पाद में घुलने वाली अशुद्धियाँ - ऑक्साइड। इस प्रकार की अशुद्धियों को ध्यान में रखने के मुद्दे का समाधान इस बात पर निर्भर करता है कि ठोस प्रतिक्रिया उत्पाद में उनका विघटन कितनी जल्दी होता है और इस प्रकार की अशुद्धियों के समावेशन के फैलाव का निकट संबंधी मुद्दा। यदि समावेशन आकार में अपेक्षाकृत बड़े हैं और उनका विघटन धीरे-धीरे होता है, तो थर्मोडायनामिक विश्लेषण में उन्हें ध्यान में नहीं रखा जाना चाहिए।
3. अशुद्धियाँ जो मूल कार्बोनेट और उसके अपघटन उत्पाद में अघुलनशील हैं। थर्मोडायनामिक विश्लेषण में इन अशुद्धियों को ध्यान में नहीं रखा जाना चाहिए, जैसे कि उनका अस्तित्व ही नहीं था। कुछ मामलों में, वे प्रक्रिया की गतिशीलता को प्रभावित कर सकते हैं।
विश्लेषण के सबसे सरल (मोटे) संस्करण में, एक ही प्रकार की सभी अशुद्धियों को संयोजित करने और उन्हें कुछ सामान्यीकृत घटक के रूप में मानने की अनुमति है। इस आधार पर, हम तीन घटकों को अलग करते हैं: बी1, बी2 और बी3। विचाराधीन थर्मोडायनामिक प्रणाली के गैस चरण पर भी चर्चा की जानी चाहिए। प्रयोगशाला कार्य में, पृथक्करण प्रक्रिया कमरे के वातावरण के साथ संचार करते हुए एक खुली स्थापना में की जाती है। इस मामले में, थर्मोडायनामिक प्रणाली में कुल दबाव स्थिर और एक वायुमंडल के बराबर होता है, और गैस चरण में एक गैसीय प्रतिक्रिया उत्पाद होता है - कार्बन डाइऑक्साइड (सीओ 2) और वायु घटक, सरलीकृत - ऑक्सीजन और नाइट्रोजन। उत्तरार्द्ध सिस्टम के अन्य घटकों के साथ बातचीत नहीं करते हैं, इसलिए, विचाराधीन मामले में, ऑक्सीजन और नाइट्रोजन अलग नहीं हैं और भविष्य में हम उन्हें तटस्थ गैसीय घटक बी कहेंगे।
तापमान रुक जाता है और साइटों में थर्मोडायनामिक व्याख्या होती है। ज्ञात चरण संरचना के साथ, थर्मोडायनामिक तरीकों का उपयोग करके रुकने वाले तापमान की भविष्यवाणी करना संभव है। आप व्युत्क्रम समस्या को भी हल कर सकते हैं - चरणों की संरचना निर्धारित करने के लिए ज्ञात तापमान का उपयोग करना। यह इस अध्ययन के ढांचे के भीतर प्रदान किया गया है।
तापमान रुकता है और प्लेटफ़ॉर्म को केवल तभी महसूस किया जा सकता है जब प्रक्रिया की गतिशीलता के संबंध में कुछ आवश्यकताएं पूरी की जाती हैं। यह अपेक्षा करना स्वाभाविक है कि ये प्रतिक्रिया स्थल पर लगभग संतुलन चरण रचनाओं और प्रसार परतों में नगण्य ग्रेडिएंट्स के लिए आवश्यकताएं हैं। ऐसी शर्तों का अनुपालन संभव है यदि प्रक्रिया की दर आंतरिक कारकों (प्रसार प्रतिरोध और रासायनिक प्रतिक्रिया के प्रतिरोध) द्वारा नियंत्रित नहीं होती है, लेकिन बाहरी कारकों द्वारा - प्रतिक्रिया स्थल पर गर्मी की आपूर्ति की दर। भौतिक रसायन विज्ञान में परिभाषित एक विषम प्रतिक्रिया के मुख्य तरीकों के अलावा: गतिज और प्रसार, इस प्रक्रिया मोड को थर्मल कहा जाता है।
ध्यान दें कि ठोस-चरण पृथक्करण प्रक्रिया का थर्मल शासन प्रतिक्रिया की अनूठी प्रकृति के कारण संभव है, जिसके लिए बड़ी मात्रा में गर्मी की आपूर्ति की आवश्यकता होती है, और साथ ही प्रारंभिक पदार्थों की आपूर्ति के कोई चरण नहीं होते हैं। प्रतिक्रिया स्थल (चूंकि एक पदार्थ का अपघटन होता है) और सीमा चरण इंटरफ़ेस से ठोस प्रतिक्रिया उत्पाद को हटाना (चूंकि यह सीमा चलती है)। केवल दो प्रसार चरण बचे हैं: गैस चरण के माध्यम से CO2 को हटाना (स्पष्ट रूप से बहुत कम प्रतिरोध के साथ) और ऑक्साइड के माध्यम से CO2 का प्रसार, जो पहले वाष्पशील द्वारा कब्जा किए गए वॉल्यूम को भरने वाले ऑक्साइड के टूटने से बहुत सुविधाजनक होता है। कार्बन मोनोआक्साइड।
आइए हम तापमान स्टॉप से नीचे के तापमान पर एक थर्मोडायनामिक प्रणाली पर विचार करें। सबसे पहले, मान लें कि कार्बोनेट में पहले और दूसरे प्रकार की कोई अशुद्धियाँ नहीं हैं। हम तीसरे प्रकार की अशुद्धता की संभावित उपस्थिति को ध्यान में रखेंगे, लेकिन केवल यह दिखाने के लिए कि ऐसा करने की आवश्यकता नहीं है। आइए मान लें कि अध्ययन के तहत पाउडर कैल्साइट का नमूना त्रिज्या के समान गोलाकार कणों से बना है आर 0 . हम कैल्साइट कणों में से एक की सतह से एक निश्चित दूरी पर थर्मोडायनामिक प्रणाली की सीमा खींचेंगे, जो इसकी त्रिज्या की तुलना में छोटी है, और इस प्रकार सिस्टम में गैस चरण की एक निश्चित मात्रा शामिल होगी।
विचाराधीन प्रणाली में 5 पदार्थ हैं: CaO, CaCO3, B3, CO2, B और उनमें से कुछ एक प्रतिक्रिया में भाग लेते हैं। इन पदार्थों को चार चरणों में वितरित किया जाता है: CaO, CaCO3, B3, गैस चरण, जिनमें से प्रत्येक को विभिन्न गुणों के अपने स्वयं के मूल्यों की विशेषता होती है और एक दृश्य (कम से कम माइक्रोस्कोप के नीचे) इंटरफ़ेस द्वारा अन्य चरणों से अलग किया जाता है। तथ्य यह है कि चरण बी 3 को बिखरे हुए कणों की एक बड़ी संख्या द्वारा दर्शाया गया है, इससे विश्लेषण नहीं बदलेगा - सभी कण गुणों में लगभग समान हैं और उन्हें एक चरण के रूप में माना जा सकता है। बाहरी दबाव स्थिर है, इसलिए केवल एक बाहरी चर है - तापमान। इस प्रकार, स्वतंत्रता की डिग्री की संख्या की गणना के लिए सभी शर्तें ( साथ) परिभाषित किया गया हैं: साथ = (5 – 1) + 1 – 4 = 1.
प्राप्त मूल्य का मतलब है कि जब तापमान (एक पैरामीटर) बदलता है, तो सिस्टम एक संतुलन स्थिति से दूसरे में चला जाएगा, और चरणों की संख्या और प्रकृति नहीं बदलेगी। सिस्टम स्थिति पैरामीटर बदल जाएंगे: कार्बन डाइऑक्साइड और तटस्थ गैस बी का तापमान और संतुलन दबाव ( टी , पी CO2 , आर वी).
कड़ाई से बोलते हुए, यह तापमान स्टॉप के नीचे किसी भी तापमान के लिए सच नहीं है, लेकिन केवल उस अंतराल के लिए जब प्रतिक्रिया, शुरू में गतिज शासन में होती है, थर्मल शासन में बदल जाती है और हम वास्तव में संतुलन के लिए सिस्टम मापदंडों की निकटता के बारे में बात कर सकते हैं . कम तापमान पर, सिस्टम काफी हद तक संतुलन से बाहर हो जाता है, लेकिन यह किसी भी तरह से समय पर नमूना तापमान की निर्भरता की प्रकृति को प्रभावित नहीं करता है।
प्रयोग की शुरुआत से ही, कमरे के तापमान पर, प्रणाली संतुलन की स्थिति में है, लेकिन केवल इसलिए कि इसमें कोई पदार्थ नहीं है जो परस्पर क्रिया कर सके। यह कैल्शियम ऑक्साइड को संदर्भित करता है, जो इन परिस्थितियों में (वायुमंडल में कार्बन डाइऑक्साइड का आंशिक दबाव लगभग 310-4 एटीएम है, संतुलन दबाव 10-23 एटीएम है) कार्बोनाइज हो सकता है। प्रतिक्रिया के लिए इज़ोटेर्म समीकरण के अनुसार, एकता के बराबर संघनित पदार्थों की गतिविधियों के साथ संतुलन स्थिरांक (16.1) की अभिव्यक्ति को ध्यान में रखते हुए लिखा गया है:
गिब्स ऊर्जा में परिवर्तन सकारात्मक है, जिसका अर्थ है कि प्रतिक्रिया विपरीत दिशा में होनी चाहिए, लेकिन यह संभव नहीं है क्योंकि सिस्टम में शुरुआत में कोई कैल्शियम ऑक्साइड नहीं है।
जैसे-जैसे तापमान बढ़ता है, पृथक्करण लोच (कार्बोनेट के ऊपर CO2 का संतुलन दबाव) बढ़ता है, जैसा कि आइसोबार समीकरण से निम्नानुसार है:
चूँकि प्रतिक्रिया का तापीय प्रभाव शून्य से अधिक है।
केवल लगभग 520 C के तापमान पर ही पृथक्करण प्रतिक्रिया थर्मोडायनामिक रूप से संभव हो जाएगी, लेकिन यह ऑक्साइड चरण के न्यूक्लियेशन के लिए आवश्यक एक महत्वपूर्ण समय विलंब (ऊष्मायन अवधि) के साथ शुरू होगी। प्रारंभ में, प्रतिक्रिया गतिज मोड में होगी, लेकिन ऑटोकैटलिसिस के कारण, गतिज चरण का प्रतिरोध तेजी से इतना कम हो जाएगा कि प्रतिक्रिया थर्मल मोड में चली जाएगी। यह इस क्षण से है कि ऊपर दिया गया थर्मोडायनामिक विश्लेषण वैध हो जाता है, और नमूने का तापमान एक काल्पनिक तुलना नमूने के तापमान से पीछे होना शुरू हो जाएगा जिसमें पृथक्करण नहीं होता है (चित्र 3 देखें)।
माना गया थर्मोडायनामिक विश्लेषण तब तक वैध रहेगा जब तक पृथक्करण लोच 1 एटीएम के मान तक नहीं पहुंच जाता। इस मामले में, 1 एटीएम के दबाव में नमूने की सतह पर कार्बन डाइऑक्साइड लगातार जारी होता है। यह हवा को विस्थापित करता है, और इसे बदलने के लिए नमूने से नए हिस्से आते हैं। कार्बन डाइऑक्साइड का दबाव एक वायुमंडल से आगे नहीं बढ़ सकता, क्योंकि गैस स्वतंत्र रूप से आसपास के वायुमंडल में चली जाती है।
सिस्टम मौलिक रूप से बदल जाता है, क्योंकि अब नमूने के आसपास गैस चरण में कोई हवा नहीं है और सिस्टम में एक घटक कम हो गया है। ऐसी प्रणाली में स्वतंत्रता की डिग्री की संख्या c = (4 - 1) + 1 - 4 = 0 है
शून्य के बराबर हो जाता है, और संतुलन बनाए रखते हुए, तापमान सहित कोई भी राज्य पैरामीटर इसमें नहीं बदल सकता है।
आइए अब ध्यान दें कि सभी निष्कर्ष (स्वतंत्रता की डिग्री की संख्या की गणना, आदि) मान्य रहेंगे यदि हम घटक बी 3 को ध्यान में नहीं रखते हैं, जो पदार्थों की संख्या और चरणों की संख्या दोनों को एक से बढ़ाता है, जो है पारस्परिक रूप से मुआवजा दिया गया।
तापमान रुकना तब होता है जब आने वाली सारी गर्मी केवल पृथक्करण प्रक्रिया पर खर्च की जाती है। सिस्टम एक बहुत अच्छे तापमान नियामक के रूप में काम करता है जब तापमान में एक छोटा सा यादृच्छिक परिवर्तन पृथक्करण दर में विपरीत परिवर्तन की ओर जाता है, जो तापमान को उसके पिछले मूल्य पर लौटा देता है। विनियमन की उच्च गुणवत्ता को इस तथ्य से समझाया गया है कि ऐसी प्रणाली व्यावहारिक रूप से जड़ता-मुक्त है।
जैसे-जैसे पृथक्करण प्रक्रिया विकसित होती है, प्रतिक्रिया मोर्चा नमूने में गहराई तक चला जाता है, जबकि अंतःक्रिया सतह कम हो जाती है और ठोस प्रतिक्रिया उत्पाद की मोटाई बढ़ जाती है, जो प्रतिक्रिया स्थल से नमूना सतह तक कार्बन डाइऑक्साइड के प्रसार को जटिल बनाती है। समय में एक निश्चित बिंदु से शुरू होकर, प्रक्रिया का थर्मल शासन मिश्रित और फिर प्रसार में बदल जाता है। पहले से ही मिश्रित मोड में, सिस्टम काफी हद तक असंतुलित हो जाएगा और थर्मोडायनामिक विश्लेषण से प्राप्त निष्कर्ष व्यावहारिक अर्थ खो देंगे।
पृथक्करण प्रक्रिया की दर में कमी के कारण, गर्मी की आवश्यक मात्रा इतनी कम हो जाएगी कि आने वाले गर्मी प्रवाह का कुछ हिस्सा फिर से सिस्टम को गर्म करने पर खर्च होना शुरू हो जाएगा। इस बिंदु से, तापमान का रुकना बंद हो जाएगा, हालांकि पृथक्करण प्रक्रिया तब तक जारी रहेगी जब तक कि कार्बोनेट पूरी तरह से विघटित न हो जाए।
यह अनुमान लगाना कठिन नहीं है कि विचाराधीन सबसे सरल मामले के लिए, रुकने वाले तापमान का मान समीकरण से पाया जा सकता है
टीडीएचटी डेटाबेस का उपयोग करके इस समीकरण का उपयोग करते हुए एक थर्मोडायनामिक गणना शुद्ध कैल्साइट के लिए 883 डिग्री सेल्सियस और शुद्ध अर्गोनाइट के लिए 834 डिग्री सेल्सियस का तापमान देती है।
अब आइए विश्लेषण को जटिल बनाएं। पहले और दूसरे प्रकार की अशुद्धियों वाले कैल्साइट के पृथक्करण के दौरान, जब कार्बोनेट और ऑक्साइड की गतिविधियों को एकता के बराबर नहीं माना जा सकता है, तो संबंधित स्थिति अधिक जटिल हो जाएगी:
यदि हम मान लें कि अशुद्धता की मात्रा कम है और परिणामी घोल को असीम रूप से पतला माना जा सकता है, तो अंतिम समीकरण को इस प्रकार लिखा जा सकता है:
संबंधित अशुद्धता का मोल अंश कहां है।
यदि एक झुका हुआ तापमान प्लेटफ़ॉर्म प्राप्त होता है और दोनों तापमान ( टी 2 > टी 1) शुद्ध कैल्शियम कार्बोनेट के लिए रुकने वाले तापमान से ऊपर - के आर (टी 1) >1 और के आर (टी 2) > 1, तो यह मान लेना उचित है कि दूसरे प्रकार की अशुद्धियाँ अनुपस्थित हैं, या उनके पास घुलने का समय नहीं है () और शुरुआत में पहले प्रकार की अशुद्धियों की सांद्रता का अनुमान लगाएं
और अंत में तापमान रुक जाता है
जैसे-जैसे प्रतिक्रिया आगे बढ़ती है, पहले प्रकार की अशुद्धता CaCO3 - B1 घोल में कुछ हद तक जमा होनी चाहिए। इस मामले में, प्लेटफ़ॉर्म झुकाव का कोणीय गुणांक संबंध द्वारा व्यक्त किया गया है:
जहां 1 घटक बी1 का अनुपात है जो शुद्ध रूप में पृथक होने पर मूल चरण में लौट आता है; वी एस- कैल्साइट की दाढ़ मात्रा; कुलपति- कार्बोनेट पृथक्करण की दर; - रुकने वाले तापमान पर पृथक्करण प्रतिक्रिया का थर्मल प्रभाव; आर 0 कैल्साइट कण की प्रारंभिक त्रिज्या है।
संदर्भ डेटा का उपयोग करके, इस सूत्र का उपयोग करके आप गणना कर सकते हैं कुलपति- विघटन दर
कैल्साइट में रेनियम घटक बी1।
2.4.2 स्थापना आरेख और कार्य प्रक्रिया
कार्य कैल्शियम कार्बोनेट और विभिन्न अंशों के डोलोमाइट के पृथक्करण का अध्ययन करता है।
प्रायोगिक सेटअप आरेख चित्र 4 में दिखाया गया है।

चित्र 4 - कार्बोनेट पृथक्करण के थर्मोग्राम का अध्ययन करने के लिए स्थापना की योजना:
1 - कोरंडम ट्यूब, 2 - कार्बोनेट, 3 - थर्मोकपल, 4 - फर्नेस,
5 - ऑटोट्रांसफॉर्मर, 6 - एडीसी बोर्ड के साथ पर्सनल कंप्यूटर
एक थर्मोकपल (3) और कैल्शियम कार्बोनेट (2) के परीक्षण नमूने के साथ एक कोरन्डम ट्यूब (1) को 1200 K पर पहले से गरम भट्टी (4) में स्थापित किया जाता है। नमूने का थर्मोग्राम पर्सनल कंप्यूटर की मॉनिटर स्क्रीन पर देखा जाता है। इज़ोटेर्मल अनुभाग से गुजरने के बाद, प्रयोग को एक अलग कार्बोनेट अंश के साथ दोहराया जाता है। डोलोमाइट का अध्ययन करते समय, दो तापमान रुकने की पहचान होने तक तापन किया जाता है।
परिणामी थर्मोग्राम "तापमान-समय" ग्राफ़ पर प्रस्तुत किए जाते हैं। तुलना में आसानी के लिए, सभी थर्मोग्राम को एक ग्राफ़ पर प्रस्तुत किया जाना चाहिए। इसका उपयोग प्रक्रिया के गहन विकास के तापमान को निर्धारित करने और थर्मोडायनामिक विश्लेषण से पाए गए तापमान के साथ तुलना करने के लिए किया जाता है। तापमान के प्रभाव, कार्बोनेट की प्रकृति और थर्मोग्राम की प्रकृति पर इसके फैलाव की डिग्री के बारे में निष्कर्ष निकाले जाते हैं।
2.4.3 माप परिणामों का प्रसंस्करण और प्रस्तुति
आपके कार्य के परिणामों के आधार पर, आपको निम्नलिखित तालिका भरनी चाहिए:
तालिका 1. कैल्शियम कार्बोनेट (डोलोमाइट) की पृथक्करण प्रक्रिया के अध्ययन के परिणाम
डेटा फ़ाइल खोले जाने पर पहले दो कॉलम मानों से भरे होते हैं; अंतिम दो कॉलमों की गणना की जानी चाहिए। स्मूथिंग पांच बिंदुओं पर की जाती है, स्मूथ किए गए डेटा का संख्यात्मक विभेदन अतिरिक्त स्मूथिंग के साथ किया जाता है, वह भी पांच बिंदुओं पर। कार्य के परिणामों के आधार पर, दो अलग-अलग निर्भरता आरेख बनाए जाने चाहिए: टी- और डी टी/डी - टी .
परिणामी तापमान स्टॉप मान ( टी एस) की तुलना शुद्ध कैल्साइट के विशेषता मान से की जानी चाहिए। यदि देखा गया मान अधिक है, तो पहले प्रकार की अशुद्धता की न्यूनतम सामग्री का अनुमान समीकरण (16.7) का उपयोग करके लगाया जा सकता है, यह मानते हुए कि दूसरे प्रकार की कोई अशुद्धियाँ नहीं हैं। यदि विपरीत संबंध देखा जाता है, तो हम यह निष्कर्ष निकाल सकते हैं कि मुख्य प्रभाव दूसरे प्रकार की अशुद्धियों द्वारा डाला जाता है और उनकी न्यूनतम सामग्री का अनुमान लगाया जाता है, बशर्ते कि पहले प्रकार की कोई अशुद्धियाँ न हों। समीकरण (16.6) से यह पता चलता है कि बाद वाले मामले में
मैनुअल में वर्णित विधि का उपयोग करके टीडीएचटी डेटाबेस का उपयोग करके संतुलन स्थिरांक के मूल्य की गणना करना उचित है। एक चरम मामले के रूप में, आप उस समीकरण का उपयोग कर सकते हैं जो तापमान के साथ कैल्शियम कार्बोनेट पृथक्करण की प्रतिक्रिया में गिब्स ऊर्जा में परिवर्तन की निर्भरता का अनुमान लगाता है:
जी 0 = बी 0 + बी 1 · टी + बी 2 · टी 2 ,
गुणांकों के मानों को बराबर लेना: बी 0 = 177820, जे/मोल; बी 1 = -162.61, जे/(मोल के), बी 3 =0.00765, जे मोल -1 के -2।
टिप्पणी . यदि "भौतिक रसायन विज्ञान" पाठ्यक्रम में छात्र टीडीएचटी डेटाबेस से परिचित नहीं हैं और उन्होंने व्यावहारिक कक्षाओं में संबंधित गणना नहीं की है, तो उन्हें श्वार्ट्समैन-टेमकिन समीकरण और संदर्भ पुस्तक से डेटा का उपयोग करना चाहिए।
परिणामों को संसाधित करने की प्रक्रिया
1. जानकारी की मैन्युअल रिकॉर्डिंग के परिणामों को एक स्प्रेडशीट फ़ाइल में दर्ज करें।
2. तापमान मूल्यों को सुचारू करना।
3. एक अलग शीट पर तापमान बनाम समय का ग्राफ बनाएं।
4. 5 बिंदुओं पर स्मूथिंग के साथ समय के साथ तापमान मूल्यों में अंतर करें।
5. एक अलग शीट पर तापमान पर समय के साथ तापमान व्युत्पन्न की निर्भरता का एक ग्राफ बनाएं, और साइटों की विशेषताओं का निर्धारण करें।
परीक्षा के परिणाम:
1. समीक्षा के लिए प्रस्तुत स्प्रेडशीट पुस्तक में, "परिणाम" शीर्षक वाले पहले पृष्ठ में निम्नलिखित जानकारी होनी चाहिए:
एक। सेल "ए1" में - तापमान स्टॉप मान (एक झुके हुए प्लेटफॉर्म के लिए औसत), सेल "बी1" में - माप की इकाइयाँ;
बी। सेल "ए2" में - तापमान रुकने की अवधि, सेल "बी2" में - माप की इकाइयाँ;
सी। सेल "ए3" में - साइट का ढलान, सेल "बी3" में - माप की इकाइयाँ;
डी। सेल "ए4" में - अशुद्धता का प्रकार या "0" यदि अशुद्धियों की उपस्थिति का पता नहीं चला है;
इ। सेल "ए5" में - अशुद्धता का मोल अंश;
एफ। सेल "ए7" से शुरू करके, कार्य के बारे में निष्कर्ष स्पष्ट रूप से तैयार किया जाना चाहिए।
सेल A1, A3 और A5 में स्प्रेडशीट बुक में अन्य शीटों पर मौजूद सेल के संदर्भ होने चाहिए, जिन पर प्रस्तुत परिणाम उत्पन्न करने के लिए गणना की गई थी, न कि स्वयं संख्यात्मक मान! यदि यह आवश्यकता पूरी नहीं होती है, तो सत्यापन कार्यक्रम "सूचना प्रस्तुत करने में त्रुटि" संदेश देता है।
2. सभी आवश्यक हस्ताक्षरों और नोटेशन के साथ स्प्रेडशीट की अलग-अलग शीट पर तापमान बनाम समय, तापमान बनाम समय बनाम तापमान का व्युत्पन्न, और तापमान बनाम समय बनाम समय का व्युत्पन्न के सही ढंग से डिज़ाइन किए गए ग्राफ़।
3. स्टॉप और उनकी अवधि के लिए तापमान का अनुमान।
4. कार्य पर निष्कर्ष.
प्रश्नों पर नियंत्रण रखें
1. जिस तापमान पर कार्बोनेट हवा में विघटित होना शुरू होता है वह किस पर निर्भर करता है?
2. बढ़ते तापमान के साथ कार्बोनाइट पृथक्करण की लोच क्यों बढ़ती है?
3. उस प्रणाली की स्वतंत्रता की डिग्री की संख्या क्या है जिसमें CaO, CO 2, CaCO 3 पदार्थों के बीच संतुलन स्थापित किया गया है?
4. यदि पृथक्करण उत्पाद मूल पदार्थ के साथ ठोस विलयन बनाता है तो थर्मोग्राम की प्रकृति कैसे बदलेगी?
5. कार्बोनेट पृथक्करण की विषम प्रतिक्रिया का कौन सा तरीका थर्मोग्राम के आइसोथर्मल अनुभाग से मेल खाता है?
6. पॉलीडिस्पर्स कार्बोनेट के पृथक्करण के दौरान थर्मोग्राम का स्वरूप कैसे बदल जाएगा?
7. 101.3 kPa और 50 kPa के कुल दबाव पर प्राप्त थर्मोग्राम के बीच क्या अंतर है?
2.5 ऑक्साइड पिघलने की चिपचिपाहट की तापमान निर्भरता का अध्ययन (कार्य संख्या 17)
2.5.1 पिघले ऑक्साइड के श्यान प्रतिरोध की प्रकृति
चिपचिपापन स्लैग पिघलने की सबसे महत्वपूर्ण भौतिक और रासायनिक विशेषताओं में से एक है। इसका आयनों की प्रसार गतिशीलता पर महत्वपूर्ण प्रभाव पड़ता है, और इसलिए स्लैग के साथ धातु की बातचीत की गतिकी, धातुकर्म इकाइयों में गर्मी की दर और बड़े पैमाने पर स्थानांतरण प्रक्रियाओं पर। चिपचिपाहट की तापमान निर्भरता का अध्ययन ऑक्साइड पिघलने में संरचनात्मक परिवर्तनों और जटिल आयनों के मापदंडों में परिवर्तन के बारे में अप्रत्यक्ष जानकारी प्रदान करता है। संरचना, और इसलिए चिपचिपाहट मूल्य, स्लैग के उद्देश्य पर निर्भर करता है। उदाहरण के लिए, धातु और स्लैग (डीसल्फराइजेशन, डीफॉस्फोराइजेशन, आदि) के रेडॉक्स इंटरैक्शन के प्रसार चरणों को तेज करने के लिए, स्लैग की संरचना का चयन किया जाता है ताकि इसकी चिपचिपाहट कम हो। इसके विपरीत, गैस चरण से स्लैग के माध्यम से स्टील में हाइड्रोजन या नाइट्रोजन के स्थानांतरण को रोकने के लिए, बढ़ी हुई चिपचिपाहट वाला स्लैग पेश किया जाता है।
चिपचिपाहट की मात्रात्मक विशेषताओं में से एक गतिशील चिपचिपाहट (η) का गुणांक हो सकता है, जिसे न्यूटन के आंतरिक घर्षण के नियम में आनुपातिकता के गुणांक के रूप में परिभाषित किया गया है।
कहाँ एफ- तरल की दो आसन्न परतों के बीच आंतरिक घर्षण बल, ग्रेड υ – वेग ढाल, एस– परतों के बीच संपर्क का सतह क्षेत्र. गतिशील श्यानता के लिए SI इकाई [η] = N s/m 2 = Pa s है।
यह ज्ञात है कि द्रव प्रवाह आसन्न स्थिर स्थिति में कणों की छलांग की एक श्रृंखला है। यह प्रक्रिया प्रकृति में सक्रिय है। छलांग लगाने के लिए, कण के पास उसके औसत मूल्य की तुलना में ऊर्जा की पर्याप्त आपूर्ति होनी चाहिए। किसी गतिमान कण के रासायनिक बंधनों को तोड़ने और पिघले हुए कण के आयतन में एक रिक्ति (गुहा) बनाने के लिए अतिरिक्त ऊर्जा आवश्यक होती है जिसमें यह गुजरता है। बढ़ते तापमान के साथ, कणों की औसत ऊर्जा बढ़ती है और उनमें से अधिक प्रवाह में भाग ले सकते हैं, जिससे चिपचिपाहट में कमी आती है। घातीय बोल्ट्ज़मैन वितरण कानून के अनुसार ऐसे "सक्रिय" कणों की संख्या तापमान के साथ बढ़ती है। तदनुसार, तापमान पर चिपचिपाहट गुणांक की निर्भरता का एक घातांकीय रूप होता है
जहां η 0 एक गुणांक है जो तापमान पर थोड़ा निर्भर है, इη - चिपचिपा प्रवाह की सक्रियण ऊर्जा। यह प्रवाह में भाग लेने में सक्षम सक्रिय कणों के एक मोल की गतिज ऊर्जा के न्यूनतम भंडार की विशेषता बताता है।
ऑक्साइड पिघलने की संरचना का चिपचिपापन गुणांक पर महत्वपूर्ण प्रभाव पड़ता है। विद्युत क्षेत्र के प्रभाव में आयनों की गति के विपरीत, श्यान प्रवाह में तरल के सभी कण क्रमिक रूप से गति की दिशा में चलते हैं। सबसे बाधित चरण बड़े कणों की गति है, जो η के मूल्य में सबसे बड़ा योगदान देता है। परिणामस्वरूप, श्यान प्रवाह की सक्रियण ऊर्जा विद्युत चालकता की तुलना में अधिक हो जाती है ( इ η > इ).
ऑक्साइड सी, पी, बी युक्त अम्लीय स्लैग में, चेन, रिंग, टेट्राहेड्रा और अन्य स्थानिक संरचनाओं के रूप में बड़े जटिल आयनों की उच्च सांद्रता होती है (उदाहरण के लिए,
और इसी तरह।)। बड़े कणों की उपस्थिति से पिघल की श्यानता बढ़ जाती है, क्योंकि उनके आंदोलन को छोटे लोगों की तुलना में अधिक ऊर्जा की आवश्यकता होती है।
मूल ऑक्साइड (CaO, MgO, MnO) के मिश्रण से पिघल में सरल धनायनों (Ca 2+, Mg 2+, Mn 2+) की सांद्रता में वृद्धि होती है। प्रक्षेपित O2- आयन पिघल के डीपोलीमराइजेशन में योगदान करते हैं, अर्थात। जटिल आयनों का अपघटन, उदाहरण के लिए,
परिणामस्वरूप, स्लैग की चिपचिपाहट कम हो जाती है।
तापमान और संरचना के आधार पर, धातुकर्म स्लैग की चिपचिपाहट काफी व्यापक सीमा (0.01 - 1 Pa s) के भीतर भिन्न हो सकती है। ये मान तरल धातुओं की चिपचिपाहट से अधिक परिमाण के क्रम हैं, जो स्लैग में अपेक्षाकृत बड़ी प्रवाह इकाइयों की उपस्थिति के कारण है।
पर η की घातांकीय निर्भरता कम हो गई टी(17.2) 35 मोल से कम वाले बुनियादी स्लैग के लिए प्रयोगात्मक डेटा का अच्छी तरह से वर्णन करता है। % SiO2. ऐसे पिघलों में श्यान प्रवाह की सक्रियण ऊर्जा होती है इη स्थिर है और इसका मान छोटा है (45 - 80 kJ/mol)। जैसे-जैसे तापमान घटता है, η थोड़ा बदलता है, और केवल जमने पर ही यह तीव्रता से बढ़ना शुरू हो जाता है।
जटिल घटकों की उच्च सांद्रता वाले अम्लीय स्लैग में, बढ़ते तापमान के साथ सक्रियण ऊर्जा कम हो सकती है: इ η = इ 0 / टी, जो गर्म करने के दौरान जटिल आयनों के पृथक्करण के कारण होता है। इस मामले में प्रायोगिक डेटा को निर्देशांक में रेखीयकृत किया गया है " एल.एनη – 1/ टी 2"।
2.5.2 चिपचिपाहट मापने के लिए स्थापना और प्रक्रिया का विवरण
चिपचिपाहट गुणांक को मापने के लिए, कार्य में एक घूर्णी विस्कोमीटर का उपयोग किया जाता है (चित्र 5)। इस उपकरण का डिज़ाइन और संचालन सिद्धांत इस प्रकार है। परीक्षण तरल (2) को एक बेलनाकार क्रूसिबल (1) में रखा जाता है, जिसमें एक लोचदार स्ट्रिंग (5) पर निलंबित स्पिंडल (4) को डुबोया जाता है। प्रयोग के दौरान, इलेक्ट्रिक मोटर (9) से टॉर्क डिस्क (7) तक और उससे स्ट्रिंग के माध्यम से स्पिंडल तक प्रेषित होता है।
ऑक्साइड पिघल की चिपचिपाहट को स्ट्रिंग के मोड़ के कोण से आंका जाता है, जो एक पैमाने (8) पर निर्धारित होता है। जब धुरी घूमती है, तो तरल पदार्थ का चिपचिपा प्रतिरोध एक ब्रेकिंग टॉर्क बनाता है जो स्ट्रिंग को तब तक घुमाता है जब तक कि स्ट्रिंग के लोचदार विरूपण का क्षण चिपचिपा प्रतिरोध बलों के क्षण के बराबर न हो जाए। इस स्थिति में, डिस्क और स्पिंडल की घूर्णन गति समान होगी। इस स्थिति के अनुरूप, स्ट्रिंग के मोड़ के कोण (∆φ) को पैमाने के सापेक्ष तीर (10) की स्थिति की तुलना करके मापा जा सकता है: प्रारंभिक - इलेक्ट्रिक मोटर चालू करने से पहले और स्थिर - चालू करने के बाद। जाहिर है, तरल η की चिपचिपाहट जितनी अधिक होगी, स्ट्रिंग ∆φ का मोड़ कोण उतना ही अधिक होगा। यदि स्ट्रिंग विरूपण सीमा से अधिक नहीं है (हुक के नियम की वैधता के अनुरूप), तो मान ∆φ η के समानुपाती होता है और लिखा जा सकता है:
समीकरण गुणांक क, जिसे विस्कोमीटर स्थिरांक कहा जाता है, क्रूसिबल और स्पिंडल के आयामों के साथ-साथ स्ट्रिंग के लोचदार गुणों पर निर्भर करता है। जैसे-जैसे डोरी का व्यास घटता जाता है, विस्कोमीटर की संवेदनशीलता बढ़ती जाती है।

चित्र 5 - चिपचिपाहट मापने के लिए स्थापना आरेख:
1 - क्रूसिबल, 2 - अध्ययन के तहत पिघलना, 3 - स्पिंडल हेड,
4 - स्पिंडल, 5 - स्ट्रिंग, 6 - इंस्टॉलेशन का ऊपरी भाग, 7 - डिस्क,
8 - स्केल, 9 - इलेक्ट्रिक मोटर, 10 - तीर, 11 - ओवन, 12 - ट्रांसफार्मर,
13 - तापमान नियंत्रण उपकरण, 14 - थर्मोकपल।
विस्कोमीटर स्थिरांक निर्धारित करने के लिए कज्ञात चिपचिपाहट वाला एक तरल क्रूसिबल में रखा जाता है - ट्रांसफार्मर तेल में रोसिन का एक समाधान। इस मामले में, कमरे के तापमान पर एक प्रयोग में ∆φ0 निर्धारित किया जाता है। फिर, किसी दिए गए तापमान पर संदर्भ तरल की चिपचिपाहट (η0) जानकर गणना करें कसूत्र के अनुसार:
मूल्य मिला कऑक्साइड पिघल के चिपचिपापन गुणांक की गणना करने के लिए उपयोग किया जाता है।
2.5.3 कार्य प्रक्रिया
धातुकर्म स्लैग की चिपचिपाहट गुणों से परिचित होने के लिए, इस प्रयोगशाला कार्य में Na 2 O · 2B 2 O 3 पिघल का अध्ययन किया जाता है। माप 850-750 डिग्री सेल्सियस के तापमान रेंज में किए जाते हैं। प्रारंभिक तापमान (850 डिग्री सेल्सियस) तक पहुंचने के बाद, विस्कोमीटर सुई को शून्य पर सेट किया जाता है। फिर इलेक्ट्रिक मोटर चालू करें और स्ट्रिंग ∆φ t के मोड़ के स्थिर कोण को ठीक करें . विस्कोमीटर को बंद किए बिना, अन्य तापमानों पर ∆φ t का माप दोहराएं। जब डोरी का मोड़ कोण 720° से अधिक होने लगे तो प्रयोग बंद कर दिया जाता है।
2.5.4 माप परिणामों का प्रसंस्करण और प्रस्तुति
माप परिणामों के आधार पर, निम्नलिखित तालिका भरें।
तालिका 1. चिपचिपाहट की तापमान निर्भरता
तालिका में, पहले दो कॉलम मॉनिटर स्क्रीन पर तापमान रीडिंग की मैन्युअल रिकॉर्डिंग और विस्कोमीटर स्केल पर धागे के मोड़ के कोण के आधार पर भरे गए हैं। शेष स्तंभों की गणना की जाती है.
तापमान (17.2) के साथ श्यानता गुणांक में परिवर्तन के घातीय नियम की व्यवहार्यता की जांच करने के लिए, निर्देशांक "Ln(η) - 10 3 / में एक ग्राफ बनाएं टी" सक्रियण ऊर्जा LINEST() (OpenOffice.calc) या LINEST() (MicrosoftOffice.Exel) फ़ंक्शन का उपयोग करके पाई जाती है, उन्हें तालिका के पांचवें और छठे कॉलम पर लागू किया जाता है।
निष्कर्ष प्राप्त डेटा η और E η की तुलना धातुकर्म स्लैग के लिए ज्ञात डेटा से करते हैं, चिपचिपाहट की तापमान निर्भरता की प्रकृति, पिघल में संरचनात्मक परिवर्तनों के साथ इसके संबंध पर चर्चा करते हैं।
परिणामों को संसाधित करने की प्रक्रिया
1. अंशांकन सेल पर माप लें और स्थापना स्थिरांक की गणना करें
2. जानकारी की मैन्युअल रिकॉर्डिंग के परिणामों को एक स्प्रेडशीट फ़ाइल में दर्ज करें।
3. श्यानता मानों की गणना करें।
4. एक अलग शीट पर श्यानता बनाम तापमान का ग्राफ बनाएं।
5. माप परिणामों के पूरे सेट के लिए चिपचिपाहट के लघुगणक और पारस्परिक निरपेक्ष तापमान की गणना करें।
6. न्यूनतम वर्ग विधि का उपयोग करके गुणांक ज्ञात करें बी 0 , बीव्युत्क्रम तापमान पर श्यानता के लघुगणक की निर्भरता का अनुमान लगाने वाले समीकरण का 1, और सक्रियण ऊर्जा की गणना करें।
7. एक अलग शीट पर, व्युत्क्रम तापमान पर श्यानता के लघुगणक की निर्भरता को आलेखित करें और एक अनुमानित निर्भरता दें परीक्षा के परिणाम:
1. समीक्षा के लिए प्रस्तुत स्प्रेडशीट पुस्तक में, "परिणाम" शीर्षक वाले पहले पृष्ठ में निम्नलिखित जानकारी होनी चाहिए:
एक। सेल "ए1" में - प्रारंभिक तापमान, सेल "बी1" में - माप की इकाइयाँ;
बी। सेल "ए2" में - अंतिम तापमान, सेल "बी2" में - माप की इकाइयाँ;
सी। सेल "ए3" में - कम तापमान पर चिपचिपे प्रवाह की सक्रियण ऊर्जा, सेल "बी3" में - माप की इकाइयाँ;
डी। सेल "ए4" में - कम तापमान पर विद्युत चालकता की तापमान निर्भरता के सूत्र में पूर्व-घातीय कारक, सेल "बी4" में - माप की इकाइयाँ;
इ। सेल "ए5" में - उच्च तापमान पर चिपचिपे प्रवाह की सक्रियण ऊर्जा, सेल "बी5" में - माप की इकाइयाँ;
एफ। सेल "ए6" में - उच्च तापमान पर विद्युत चालकता की तापमान निर्भरता के सूत्र में पूर्व-घातीय कारक, सेल "बी6" में - माप की इकाइयाँ;
जी। सेल "ए7" से शुरू करके, कार्य के बारे में निष्कर्ष स्पष्ट रूप से तैयार किया जाना चाहिए।
कक्ष A1-A6 में स्प्रेडशीट पुस्तक की अन्य शीटों पर कक्षों के संदर्भ होने चाहिए, जिन पर प्रस्तुत परिणाम प्राप्त करने के लिए गणना की गई थी, न कि स्वयं संख्यात्मक मान! यदि यह आवश्यकता पूरी नहीं होती है, तो सत्यापन कार्यक्रम "सूचना प्रस्तुत करने में त्रुटि" संदेश देता है।
2. सभी आवश्यक हस्ताक्षरों और प्रतीकों के साथ स्प्रेडशीट की अलग-अलग शीटों पर, प्रयोगात्मक डेटा (बिंदुओं) से प्राप्त और बहुपद (रेखा) द्वारा अनुमानित, तापमान पर चिपचिपाहट की निर्भरता और व्युत्क्रम तापमान पर चिपचिपाहट के लघुगणक के सही ढंग से डिज़ाइन किए गए ग्राफ़ . प्रश्नों पर नियंत्रण रखें
1. CaO, Na 2 O, SiO 2, B 2 O 3, Al 2 O 3 से युक्त ऑक्साइड के घटक किस रूप में पिघलते हैं?
2. श्यानता गुणांक किसे कहते हैं?
3. जब स्लैग में मूल ऑक्साइड मिलाए जाते हैं तो स्लैग की श्यानता की तापमान निर्भरता कैसे बदल जाएगी?
4. श्यानता को किन इकाइयों में मापा जाता है?
5. विस्कोमीटर स्थिरांक कैसे निर्धारित किया जाता है?
6. श्यान प्रवाह की सक्रियण ऊर्जा क्या निर्धारित करती है?
7. बढ़ते तापमान के साथ श्यानता में कमी का क्या कारण है?
8. श्यान प्रवाह की सक्रियण ऊर्जा की गणना कैसे की जाती है?
2.6 ऑक्साइड पिघल से स्टील में मैंगनीज की कमी
(कार्य क्रमांक 18)
2.6.1 धातु और धातुमल के बीच विद्युत रासायनिक संपर्क के सामान्य सिद्धांत
पिघले हुए धातुमल के साथ तरल धातु की परस्पर क्रिया की प्रक्रियाएं अत्यधिक तकनीकी महत्व की हैं और कई धातुकर्म इकाइयों में होती हैं। इन इकाइयों की उत्पादकता, साथ ही तैयार धातु की गुणवत्ता, चरण सीमा के पार कुछ तत्वों के संक्रमण की गति और पूर्णता से काफी हद तक निर्धारित होती है।
विभिन्न चरणों में महत्वपूर्ण संख्या में भौतिक और रासायनिक प्रक्रियाओं की एक साथ घटना, उच्च तापमान, और हाइड्रोडायनामिक और गर्मी प्रवाह की उपस्थिति औद्योगिक और प्रयोगशाला स्थितियों में चरणों की बातचीत की प्रक्रियाओं का प्रयोगात्मक अध्ययन करना मुश्किल बनाती है। ऐसी जटिल प्रणालियों का अध्ययन उन मॉडलों का उपयोग करके किया जाता है जो विचाराधीन वस्तु के व्यक्तिगत, लेकिन सबसे महत्वपूर्ण पहलुओं को दर्शाते हैं। इस कार्य में, मेटल-स्लैग इंटरफ़ेस पर होने वाली प्रक्रियाओं का एक गणितीय मॉडल हमें समय के आधार पर घटकों की वॉल्यूमेट्रिक सांद्रता में परिवर्तन और इंटरफ़ेस में उनके संक्रमण की दर का विश्लेषण करने की अनुमति देता है।
ऑक्साइड पिघल से मैंगनीज की कमी एक विद्युत रासायनिक अर्ध-प्रतिक्रिया द्वारा होती है:
(एमएन 2+) + 2ई =
साथ की प्रक्रियाएँ ऑक्सीकरण प्रक्रियाएँ होनी चाहिए। जाहिर है, यह आयरन ऑक्सीकरण प्रक्रिया हो सकती है
= (Fe2+) + 2e
या स्टील संरचना में अशुद्धियाँ, उदाहरण के लिए, सिलिकॉन। चूंकि चार-आवेशित सिलिकॉन आयन स्लैग में मौजूद नहीं हो सकता है, यह प्रक्रिया इलेक्ट्रोकेमिकल अर्ध-प्रतिक्रिया के अनुसार सिलिकॉन-ऑक्सीजन टेट्राहेड्रॉन के गठन के साथ होती है:
4(O 2-) = (SiO 4 4-) + 4e
दिए गए इलेक्ट्रोड अर्ध-प्रतिक्रियाओं में से केवल एक की स्वतंत्र घटना असंभव है, क्योंकि इससे चरण सीमा पर विद्युत दोहरी परत में आवेशों का संचय होता है, जो पदार्थ के संक्रमण को रोकता है।
उनमें से प्रत्येक के लिए संतुलन की स्थिति संतुलन इलेक्ट्रोड क्षमता द्वारा विशेषता है ()
मानक क्षमता कहां है, पदार्थ के ऑक्सीकृत और कम रूपों की गतिविधि है, जेड– इलेक्ट्रोड प्रक्रिया में भाग लेने वाले इलेक्ट्रॉनों की संख्या, आर– सार्वभौमिक गैस स्थिरांक, एफ– फैराडे स्थिरांक, टी- तापमान।
स्लैग से धातु में मैंगनीज की कमी कम से कम दो इलेक्ट्रोड अर्ध-प्रतिक्रियाओं की संयुक्त घटना के परिणामस्वरूप महसूस की जाती है। उनकी गति इस प्रकार निर्धारित की जाती है कि इंटरफ़ेस पर आवेशों का कोई संचय न हो। इस मामले में, धातु की क्षमता एक स्थिर मान लेती है, जिस पर इलेक्ट्रॉनों की पीढ़ी और आत्मसात की दर समान होती है। वास्तविक के बीच का अंतर, अर्थात्। स्थिर क्षमता और इसके संतुलन मान को इलेक्ट्रोड का ध्रुवीकरण (ओवरवोल्टेज) कहा जाता है। ध्रुवीकरण एक प्रणाली को संतुलन से हटाने की डिग्री को दर्शाता है और इलेक्ट्रोकेमिकल कैनेटीक्स के नियमों के अनुसार चरण सीमा के पार घटकों के संक्रमण की दर निर्धारित करता है।
शास्त्रीय थर्मोडायनामिक्स के दृष्टिकोण से, सिस्टम में एक दिशा या किसी अन्य में प्रक्रियाएँ लोहे में घुले सिलिकॉन द्वारा स्लैग से मैंगनीज की वसूली में होती हैं:
2(MnO) + = 2 + (SiO 2) H = -590 kJ/mol
और स्वयं विलायक (स्लैग में आयरन ऑक्साइड के साथ मैंगनीज का ऑक्सीकरण)।
(एमएनओ) + = + (FeO) =। एच = 128 केजे/मोल
औपचारिक गतिकी के दृष्टिकोण से, पहली प्रतिक्रिया की दर, उदाहरण के लिए, गतिज शासन में संतुलन से दूर धातु में सिलिकॉन सामग्री में परिवर्तन से निर्धारित होती है, जो मैंगनीज ऑक्साइड की सांद्रता के उत्पाद पर निर्भर होनी चाहिए धातु में कुछ हद तक धातुमल और सिलिकॉन। प्रसार मोड में, प्रतिक्रिया दर उस घटक की एकाग्रता पर रैखिक रूप से निर्भर होनी चाहिए जिसका प्रसार बाधित है। दूसरी प्रतिक्रिया के लिए भी ऐसा ही तर्क दिया जा सकता है।
किसी प्रतिक्रिया का संतुलन स्थिरांक गतिविधि के रूप में व्यक्त किया जाता है
यह केवल तापमान का कार्य है।
धातुमल और धातु में मैंगनीज की संतुलन सांद्रता का अनुपात
इसे मैंगनीज का वितरण गुणांक कहा जाता है, जो इसके विपरीत, चरणों की संरचना पर निर्भर करता है और स्लैग और धातु के बीच इस तत्व के वितरण की मात्रात्मक विशेषता के रूप में कार्य करता है।
2.6.2 प्रक्रिया मॉडल
सिमुलेशन मॉडल तीन इलेक्ट्रोड अर्ध-प्रतिक्रियाओं पर विचार करता है जो ऑक्साइड पिघल CaO - MnO - FeO - SiO 2 - Al 2 O 3 और अशुद्धियों के रूप में Mn और Si युक्त तरल लोहे के बीच हो सकती हैं। उनकी घटना के प्रसार मोड के बारे में एक धारणा बनाई गई है। दोनों चरणों में स्लैग, धातु में सिलिकॉन और मैंगनीज में Fe 2+ कणों के प्रसार के अवरोध को ध्यान में रखा जाता है। मॉडल का वर्णन करने वाले समीकरणों की सामान्य प्रणाली का रूप है
कहाँ υ ј – इलेक्ट्रोड अर्ध-प्रतिक्रिया की दर, η जे- ध्रुवीकरण, मैं जे- सीमित प्रसार धारा का घनत्व, डीजे- प्रसार गुणांक, β - संवहन स्थिरांक, सी जे- एकाग्रता।
सिमुलेशन मॉडल प्रोग्राम आपको समीकरणों की प्रणाली (18.4) - (18.8) को हल करने की अनुमति देता है, जो यह स्थापित करना संभव बनाता है कि स्लैग के साथ धातु की बातचीत के दौरान घटकों की मात्रा एकाग्रता और उनके संक्रमण दर समय के साथ कैसे बदलते हैं। गणना परिणाम प्रदर्शित होते हैं. मॉनिटर स्क्रीन से प्राप्त जानकारी में मुख्य घटकों की सांद्रता, उनके वर्तमान मूल्यों, साथ ही तापमान मूल्यों और संवहन स्थिरांक (चित्रा 8) में परिवर्तन का ग्राफिकल प्रतिनिधित्व शामिल है।
धातु और स्लैग की परस्पर क्रिया के सिमुलेशन मॉडल के लिए प्रोग्राम का ब्लॉक आरेख चित्र 7 में प्रस्तुत किया गया है। प्रोग्राम एक चक्र में संचालित होता है जो निर्दिष्ट सिमुलेशन समय (लगभग 10 मिनट) बीत जाने के बाद ही रुकता है।
चित्र 7 - सिमुलेशन मॉडल प्रोग्राम का ब्लॉक आरेख
2.6.3 कार्य प्रक्रिया
सिमुलेशन प्रोग्राम द्वारा उत्पन्न छवि चित्र 8 (दाएं पैनल) में दिखाई गई है। पैनल के शीर्ष पर मापी गई मात्राओं के संख्यात्मक मान चुने गए हैं; ग्राफ़ प्रक्रिया सिमुलेशन के दौरान प्राप्त सभी मान प्रदर्शित करता है। धातु और स्लैग पिघलने के घटकों के पदनाम में, धातुकर्म विषयों पर साहित्य में स्वीकृत अतिरिक्त प्रतीकों का उपयोग किया जाता है। वर्गाकार कोष्ठक इंगित करते हैं कि घटक धातु पिघल से संबंधित है, और गोल कोष्ठक इंगित करते हैं कि घटक स्लैग पिघल से संबंधित है। घटक पदनामों में गुणक का उपयोग केवल प्लॉटिंग उद्देश्यों के लिए किया जाता है और मूल्यों की व्याख्या करते समय इसे ध्यान में नहीं रखा जाना चाहिए। मॉडल के संचालन के दौरान, किसी भी समय केवल मापी गई मात्राओं में से एक का मूल्य प्रदर्शित होता है। 6 सेकंड के बाद यह गायब हो जाता है और अगला मान प्रकट होता है। इस अवधि के दौरान, आपके पास अगला मान लिखने के लिए समय होना चाहिए। समय बचाने के लिए, यह अनुशंसा की जाती है कि स्थिर संख्याएँ न लिखें, उदाहरण के लिए, तापमान मान में अग्रणी इकाई।

चित्र 8. प्रक्रियाओं के विभिन्न चरणों में कार्य संख्या 18 निष्पादित करते समय मॉनिटर स्क्रीन की छवि।
इंस्टॉलेशन शुरू होने के चार से पांच मिनट बाद, स्लैग में पहले से गरम किया हुआ मैंगनीज ऑक्साइड मिलाएं, जो आपके इंस्टॉलेशन के नंबर के साथ मुख्य कीबोर्ड पर Alt कुंजी और नंबर कुंजी को एक साथ दबाकर किया जाता है। परिणामों को संसाधित करने का क्रम:
1. जानकारी की मैन्युअल रिकॉर्डिंग के परिणामों को एक स्प्रेडशीट फ़ाइल में दर्ज करें।
2. 1400 किलोग्राम धातु के पिघले द्रव्यमान के साथ स्लैग में मैंगनीज ऑक्साइड जोड़ने से पहले और बाद में इंटरफ़ेज़ सीमा के पार तत्वों के संक्रमण की प्रक्रियाओं की दर और इन मूल्यों के लघुगणक की गणना करें।
3. अलग-अलग शीट पर तापमान बनाम समय, मैंगनीज संक्रमण दर बनाम समय, सिलिकॉन संक्रमण दर का लघुगणक बनाम धातु में सिलिकॉन एकाग्रता का लघुगणक के ग्राफ बनाएं।
4. न्यूनतम वर्ग विधि का उपयोग करके, सिलिकॉन संक्रमण प्रक्रिया की गतिज विशेषताओं का अनुमान लगाएं।
परीक्षा के परिणाम:
1. सभी आवश्यक हस्ताक्षरों और नोटेशन के साथ स्प्रेडशीट की एक अलग शीट पर, पिछले अनुभाग में सूचीबद्ध सही ढंग से स्वरूपित ग्राफ़।
2. मैंगनीज ऑक्साइड की शुरूआत से पहले और बाद में सिलिकॉन ऑक्सीकरण प्रतिक्रिया के क्रम का मान, त्रुटियों का संकेत।
3. कार्य पर निष्कर्ष.
प्रश्नों पर नियंत्रण रखें
1. इस्पात उत्पादन प्रक्रियाओं को मॉडल बनाने की आवश्यकता क्यों है?
2. धातु की धातुमल के साथ परस्पर क्रिया की प्रकृति क्या है और यह कैसे प्रकट होती है?
3. किस विभव को स्थिर कहा जाता है?
4. किस विभव को संतुलन कहते हैं?
5. इलेक्ट्रोड ध्रुवीकरण (ओवरवोल्टेज) क्या है?
6. धातु और धातुमल के बीच मैंगनीज का वितरण गुणांक क्या है?
7. धातु और धातुमल के बीच मैंगनीज का वितरण स्थिरांक किस पर निर्भर करता है?
8. प्रसार मोड में मैंगनीज के धातु से स्लैग में संक्रमण की दर को कौन से कारक प्रभावित करते हैं?
ग्रन्थसूची
1. लिंचेव्स्की, बी.वी. धातुकर्म प्रयोग की तकनीक [पाठ] / बी.वी. लिंचेव्स्की। - एम.: धातुकर्म, 1992. - 240 पी।
2. आर्सेनटिव, पी.पी. धातुकर्म प्रक्रियाओं के अध्ययन के लिए भौतिक-रासायनिक तरीके [पाठ]: विश्वविद्यालयों के लिए पाठ्यपुस्तक / पी.पी. अर्सेंटिएव, वी.वी. याकोवलेव, एम.जी. क्रशेनिनिकोव, एल.ए. प्रोनिन एट अल। - एम .: धातुकर्म, 1988. - 511 पी।
3. पोपेल, एस.आई. गैस और स्लैग के साथ पिघली हुई धातु की परस्पर क्रिया [पाठ]: पाठ्यपुस्तक / एस.आई. पोपेल, यू.पी. निकितिन, एल.ए. बर्मिन और अन्य - स्वेर्दलोव्स्क: एड। यूपीआई के नाम पर सेमी। किरोवा, 1975, - 184 पी.
4. पोपेल, एस.आई. धातुकर्म प्रक्रियाओं का सिद्धांत [पाठ]: पाठ्यपुस्तक / एस.आई. पोपेल, ए.आई. सोतनिकोव, वी.एन. बोरोनेन्कोव। - एम.: धातुकर्म, 1986. - 463 पी.
5. लेपिंस्कीख, बी.एम. धातु और स्लैग पिघलने के परिवहन गुण [पाठ]: निर्देशिका / बी.एम. लेपिंस्कीख, ए.ए. बेलौसोव/अंडर। ईडी। वटोलिना एन.ए. - एम.: धातुकर्म, 1995. - 649 पी।
6. बेले, जी.ई. धातुकर्म प्रयोग का संगठन [पाठ]: पाठ्यपुस्तक / जी.ई. बेले, वी.वी. डेम्बोव्स्की, ओ.वी. सोत्सेंको। - एम.: रसायन विज्ञान, 1982. - 228 पी।
7. पैन्फिलोव, ए.एम. उच्च तापमान पर थर्मोडायनामिक गुणों की गणना [इलेक्ट्रॉनिक संसाधन]: सभी प्रकार की शिक्षा के धातुकर्म और भौतिक इंजीनियरिंग संकाय के छात्रों के लिए शैक्षिक और पद्धति संबंधी मैनुअल / ए.एम. पैन्फिलोव, एन.एस. सेमेनोवा - एकाटेरिनबर्ग: यूएसटीयू-यूपीआई, 2009. - 33 पी।
8. पैन्फिलोव, ए.एम. एक्सेल स्प्रेडशीट में थर्मोडायनामिक गणना [इलेक्ट्रॉनिक संसाधन]: शिक्षा के सभी रूपों के धातुकर्म और भौतिकी-तकनीकी संकायों के छात्रों के लिए दिशानिर्देश / ए.एम. पैन्फिलोव, एन.एस. सेमेनोवा - येकातेरिनबर्ग: यूएसटीयूयूपीआई, 2009. - 31 पी।
9. भौतिक एवं रासायनिक मात्राओं की संक्षिप्त संदर्भ पुस्तक/पॉड। ईडी। ए.ए. रावडेल और ए.एम. पोनोमेरेवा। एल.: रसायन विज्ञान, 1983. - 232 पी।
कजाकिस्तान गणराज्य के शिक्षा और विज्ञान मंत्रालय, आरएसई "कारगांडा राज्य औद्योगिक विश्वविद्यालय" "धातुकर्म और सामग्री विज्ञान" विभाग, विशेष 6M070900 में मास्टर डिग्री के लिए प्रवेश परीक्षा कार्यक्रम - "धातुकर्म" टेमिरटौ, 2013 1 धातुकर्म प्रक्रियाओं के सिद्धांत के मूल सिद्धांत। धातुओं का लौह और अलौह में विभाजन। धातुओं और मिश्र धातुओं के उत्पादन में उपयोग किए जाने वाले भौतिक और रासायनिक संतुलन के बुनियादी नियम। संतुलन की परिकलित विशेषताएँ। 2. धातुकर्म उत्पादन के लिए कच्चा माल और उनकी तैयारी। अयस्क. अयस्कों की सामान्य विशेषताएँ। धातुकर्म उत्पादन के लिए ईंधन, ठोस, तरल और गैसीय। गलाने के लिए अयस्कों की तैयारी। अयस्कों के लाभकारीीकरण, कुचलने और एकत्रीकरण के योजनाबद्ध आरेख। अयस्कों के एकत्रीकरण के दौरान होने वाली प्रक्रियाएँ। आवेश के मुख्य घटक 3. लौह उत्पादन। उत्पादन प्रक्रिया का सामान्य आरेख. ब्लास्ट फर्नेस प्रोफाइल. मूल तत्व और उनका उद्देश्य. फ्लक्स और ब्लास्ट फर्नेस ईंधन। लौह आक्साइड का अपचयन और कार्बन यौगिकों का अपघटन। सिलिकॉन और मैंगनीज की कमी. ब्लास्ट फर्नेस के फोर्ज में प्रक्रियाएं। स्लैग का निर्माण और उसके भौतिक गुण। सल्फर हटाना. तकनीकी और आर्थिक संकेतक. 4. इस्पात उत्पादन. स्टील्स का वर्गीकरण. प्राप्ति के तरीके. इस्पात निर्माण के लिए सामग्री चार्ज करें। धात्विक और अधात्विक समूह। इस्पात निर्माण प्रक्रियाओं के थर्मोडायनामिक्स और कैनेटीक्स। स्टील स्लैग. उनकी शिक्षा के स्रोत. भौतिक-रासायनिक विशेषताएँ। इस्पात निर्माण प्रक्रियाओं की बुनियादी प्रतिक्रियाएँ। सिलिकॉन, मैंगनीज, सल्फर और फास्फोरस का व्यवहार। स्टील में गैसें और गैर-धात्विक समावेशन। हटाने के तरीके. स्टील का डीऑक्सीडेशन मिश्रधातु बनाना। डीऑक्सीडेशन के तरीके। 5. कन्वर्टर्स में स्टील का उत्पादन। 2 कनवर्टर प्रक्रियाओं के सामान्य सिद्धांत और प्रकार। एलडी प्रक्रिया का योजनाबद्ध आरेख। बुनियादी डिज़ाइन तत्व. एलडी प्रक्रिया का उपयोग करके गलाने के सामान्य सिद्धांत। टीईपी प्रक्रिया. 6. निचली प्रक्रियाएँ। खुली चूल्हा भट्टी के संचालन की योजना। भट्टी के मूल तत्व. प्रक्रिया की किस्में. गैस चरण की ऑक्सीडेटिव प्रकृति। ईंधन। पिघलने की अवधि. अशुद्धियों का ऑक्सीकरण. मुख्य स्क्रैप अयस्क और स्क्रैप प्रक्रियाओं के दौरान गलाने की प्रगति। भट्टी के तापीय कार्य और कार्बन ऑक्सीकरण की दर के बीच संबंध। खुले चूल्हे की प्रक्रिया की किस्में। ऑक्सीजन के साथ गलाने की तीव्रता. डबल स्नान ओवन. इस्पात की गुणवत्ता और प्रक्रिया के तकनीकी और आर्थिक संकेतक। 7. विद्युत भट्टियों में इस्पात गलाना। चिपबोर्ड के संरचनात्मक तत्व। विद्युत नक़्शा। इलेक्ट्रोड. मुख्य ईएएफ में स्टील गलाने की तकनीकी विशेषताएं। पिघलने की अवधि. हेवी-ड्यूटी भट्टियों में विभिन्न प्रकार की गलाने की तकनीक। 8. इलेक्ट्रिक रीमेल्टिंग भट्टियों में स्टील गलाना। प्रेरण भट्टियों में इस्पात गलाना। चिपबोर्ड की तुलना में प्रौद्योगिकी के लाभ। ईएसआर, वीडीपी प्रक्रियाएं। 9. लौहमिश्र धातु का उत्पादन। टीआई, वी. प्रक्रियाओं के तकनीकी और आर्थिक संकेतकों के आधार पर फेरोअलॉय के एक छोटे समूह की उत्पादन तकनीक के मूल सिद्धांत। 10. अलौह धातुओं का उत्पादन। सामान्य जानकारी। उत्पादन के तरीके (पाइरो-, हाइड्रो- और इलेक्ट्रोमेटलर्जिकल)। तांबे का धातुकर्म. तांबे के उत्पादन के लिए पाइरोमेटालर्जिकल विधि की योजना। प्रतिध्वनि और विद्युत भट्टियों में मैट के लिए सांद्रणों को भूनना और गलाना। कॉपर मैट परिवर्तित करना। तांबे का शोधन. 3 11. एल्यूमिनियम धातुकर्म। एल्यूमिनियम धातुकर्म. एल्युमीनियम उत्पादन के लिए कच्चा माल और विधियाँ। एल्युमीनियम उत्पादन योजना. एल्युमिना उत्पादन. एल्यूमिनियम शोधन. 12. दुर्दम्य धातुओं का उत्पादन। दुर्दम्य धातुओं का उत्पादन. धातु उत्पादन के लिए क्लोराइड विधियाँ। टाइटेनियम उत्पादन की मूल बातें। कच्चा माल। टाइटेनियम टेट्रोक्लोराइड की तैयारी. टाइटेनियम के उत्पादन के लिए आयोडाइड विधि। दुर्दम्य धातुओं का उत्पादन. टंगस्टन उत्पादन तकनीक। अयस्क लाभकारी. टंगस्टन सांद्रण प्रसंस्करण योजना। WO3 से धातु टंगस्टन पाउडर तैयार करना। 13. लोहे की एक्स्ट्राडोमेन प्राप्ति। गैर-डोमेन लौह उत्पादन की प्रक्रियाओं की सामान्य विशेषताएँ। 14. खदान में कमी और गलाने की प्रक्रिया। शाफ्ट भट्टियों में स्पंज आयरन का उत्पादन। 15. समय-समय पर संचालित रिटॉर्ट्स में स्पंज आयरन का उत्पादन। इकाई का संचालन सिद्धांत, प्रयुक्त कच्चा माल और ईंधन। विधि के फायदे और नुकसान. 16. द्रवीकृत बिस्तर में स्पंज आयरन का उत्पादन इकाई के संचालन का सिद्धांत, प्रयुक्त कच्चा माल और ईंधन। विधि के फायदे और नुकसान. 17. रोटरी भट्ठे में स्पंज आयरन का उत्पादन इकाई के संचालन का सिद्धांत, प्रयुक्त कच्चा माल और ईंधन। विधि के फायदे और नुकसान. 4 18. सतत भट्टियों में स्पंज आयरन का उत्पादन इकाई के संचालन का सिद्धांत, प्रयुक्त कच्चा माल और ईंधन। विधि के फायदे और नुकसान. 19. पाउडर धातुकर्म पाउडर धातुकर्म उत्पादों और बुनियादी अवधारणाओं का वर्गीकरण। 20. धातु चूर्ण के गुण। तकनीकी, रासायनिक और भौतिक गुण। 21. चूर्ण तैयार करना. यांत्रिक प्रसंस्करण विधियाँ और भौतिक-रासायनिक विधियाँ। 22. मोल्डिंग के लिए पाउडर सामग्री तैयार करना। इन कार्यों को करने के लिए वर्गीकरण, औसतीकरण, मिश्रण और उपकरण। 23. मोल्डिंग प्रक्रिया की सामान्य अवधारणाएँ और सैद्धांतिक नींव। पाउडर सामग्री के गुणों के आधार पर प्लास्टिक विकृतियाँ, संघनन। घटकों की खुराक, मिश्रण। मोल्डिंग में प्रयुक्त उपकरण. 24. दबाने के दौरान दोष और इसके घटित होने में योगदान देने वाले कारक। दोषों के कारण एवं निवारण के उपाय। 25. चूर्ण लपेटना। कुछ उत्पादों को प्राप्त करने के लिए उपयोग की जाने वाली एक विधि। 5 अनुशंसित साहित्य मूल साहित्य: 1. वोस्कोबॉयनिकोव वी.जी., कुद्रिन वी.ए., याकुशेव ए.एम. सामान्य धातुकर्म. - एम.: आईसीसी "अकाडेमक्निगा"। 2002. - 786 पी. 2. अर्सेंटीव एम.पी., याकोवलेव वी.वी., क्रशेनिनिकोव एम.जी. और अन्य। सामान्य धातुकर्म। - एम: धातुकर्म। 1986.-360 पी. 3. यावोइस्की वी.आई., क्रायाकोवस्की यू.वी., ग्रिगोरिएव वी.पी. और अन्य। इस्पात धातु विज्ञान। एम. "धातुकर्म", 1983, 583 पी. भ्रम से. 4. बिगेव ए.एम., बिगेव वी.ए., इस्पात धातुकर्म। मैग्नीटोगोर्स्क, एमएसटीयू, 2000 - 542 पी। 5. कुद्रिन वी.ए. इस्पात उत्पादन का सिद्धांत और प्रौद्योगिकी। - एम.: मीर. 2003 - 528पी. 6. बोर्नत्स्की आई.आई., मिखनेविच वी.एफ., यार्गिन एस.ए. इस्पात उत्पादन. एम.: धातुकर्म. 1991. – 400 एस. 7. सोकोलोव जी.ए. इस्पात उत्पादन. एम., "धातुकर्म", 1982, 496 पी. भ्रम से. 8. शिश्किन यू.आई., मर्चेंट ए.के., ग्रिगोरोवा ओ.ए. कनवर्टर प्रक्रियाओं का सिद्धांत और प्रौद्योगिकी। अल्माटी. जिम. 2006.-192 पी. 9. बोर्नत्स्की आई.आई. मिखनेविच वी.एफ., यार्गिन एस.ए. इस्पात उत्पादन. एम., "धातुकर्म", 1991, 400 पी. 10. शिश्किन यू.आई., लुकिन जी.पी. धातुकर्म गणना, अल्माटी आरआईके., 2002. - 115 पी। 11. राइस एम.ए. लौहमिश्र धातु का उत्पादन।-एम: धातुकर्म। 1985-344पी. 12. पोपेल एस.आई., सोतनिकोव ए.आई., बोरोनेंकोव वी.एन. धातुकर्म प्रक्रियाओं का सिद्धांत।-एम: धातुकर्म, 1986.-464पी। 13. एजेनकोव वी.जी., मिखिन हां.या. धातुकर्म गणना. एम: धातुकर्म। 1962, -208 पी। 14. एडनरल एफ.पी., फ़िलिपोव ए.एफ. इस्पात और लौहमिश्र धातु के विद्युत धातुकर्म के लिए गणना। -एम.: मेटालर्जिज़डैट, 1978.-230 पी। 6 15. क्रामारोव ए.डी., सोकोलोव ए.एन. इस्पात और लौहमिश्र धातु का विद्युत धातुकर्म। -एम.: धातुकर्म, 1976.-375 पी. 16. मर्चेंट ए.के., शिश्किन यू.आई. अर्टिकबाएव ओ.ए. धातुओं के भट्टी के बाहर प्रसंस्करण के लिए सिद्धांत, प्रौद्योगिकी और उपकरण। - अल्माटी: जिम, 2004.-273पी। 17. सेव्रीयुकोव एन.एन., कुज़मिन बी.ए., चेलिशचेव ई.वी. सामान्य धातुकर्म। एम.: धातुकर्म, 1976.-568 पी। 18. सामान्य धातुकर्म (लौह और अलौह धातुओं का धातुकर्म)। ई.वी. चेलिशचेव द्वारा संपादित। - एम: धातुकर्म, 1971.-480 पी। 19. कनीज़ेव वी.एफ. कोक मुक्त लौह धातुकर्म। एम: धातुकर्म, 1972 20. तेलुगाबुलोव एस.एम. धातुओं, मिश्र धातुओं और उन्नत सामग्रियों के उत्पादन के लिए सैद्धांतिक नींव। अल्माटी: शैक्षिक और पद्धति संबंधी साहित्य पर आरआईके प्रकाशन, 2001, 332 पृष्ठ 21. किपरिसोव एस.एस., लिबेंसन जी. पाउडर धातुकर्म। पाठ्यपुस्तक। एम. "धातुकर्म", 1997. अतिरिक्त साहित्य 1. इश्मुखमेदोव एन.के. कजाकिस्तान की लौह धातु विज्ञान। अल्माटी: वैज्ञानिक अनुसंधान केंद्र। "जिल्म", 2002.-50 पी। 2. इस्पात और लौहमिश्र धातु का विद्युत धातुकर्म। डोवोलोत्स्की डी.वाई.ए. द्वारा संपादित। एम.: धातुकर्म, 1984.-438 पी। 3. गैसिक एम.आई., लयाकिशेव एन.पी. एम्लिन बी.आई. लौहमिश्र धातु उत्पादन का सिद्धांत और प्रौद्योगिकी। -एम.: धातुकर्म, 1988.-784 पी. 4. शिश्किन यू.आई., पोल्शिकोव जी.वी., बोगोमायाकोव वी.आई. हेवी-ड्यूटी कन्वर्टर्स में फॉस्फोरस कास्ट आयरन के पुनर्वितरण में चूने का उपयोग करने की दक्षता।-कारगांडा: यूएसएसआर के वैज्ञानिक और इंजीनियरिंग सोसायटी संघ, 1991.-43पी। 5. यावोइस्की वी.आई., लेविन एस.एल., बैपटिस्टमैन्स्की वी.आई. और अन्य। इस्पात की धातुकर्म। एम.: धातुकर्म 1973.-816 पी। भ्रम से. 6. मेडझिबोझस्की एम.वाई.ए. इस्पात निर्माण प्रक्रियाओं के ऊष्मागतिकी और गतिकी के मूल सिद्धांत। कीव, "विशा स्कूल", 1979, 276 पी. भ्रम से. 7 7. लिंचेव्स्की बी.वी., सोबोलेव्स्की ए.एल., कलमेनेव ए.ए. लौह धातुओं का धातुकर्म. - एम.: धातुकर्म, 1986. - 360 पी। 8. पोनोमेरेवा के.एस. भौतिक रसायन विज्ञान में समस्याओं का संग्रह। - एम.: मेटलर्जिज़डैट, 1962.-232पी। 9. अर्सेंटिव एम.पी., याकोवलेव वी.वी., क्रशेनिनिकोव एम.जी. और अन्य। सामान्य धातुकर्म। - एम: धातुकर्म। 1986.-360 पी. 10. तेलुगाबुलोव एस.एम. कार्बन के साथ लोहे की ठोस-चरण कमी का सिद्धांत और तकनीक। अल्माटी: जिम, 1992. 311 पी। 11. किपरिसोव एस.एस., लिबेंसन जी. पाउडर धातुकर्म। पाठ्यपुस्तक। एम. "धातुकर्म", 1972, 528 पी. 8
लौह धातुओं का धातुकर्म
आप विवरण के अंत में पुस्तक को डीजेवीयू प्रारूप में डाउनलोड कर सकते हैं।
खण्ड एक। कच्चा लोहा धातुकर्म
अध्याय I. ब्लास्ट फर्नेस गलाने का कच्चा माल
§1. प्रभारी सामग्री के लिए आवश्यकताएँ
§ 2. लौह अयस्क
§ 3. मैंगनीज अयस्क
§ 4. फ़्लक्स
§ 5. उत्पादन अपशिष्ट
§ 6. ब्लास्ट फर्नेस ईंधन
दूसरा अध्याय। लौह अयस्कों की तैयारी
§1. अयस्क को कुचलना और पीसना
§ 2. अयस्क छँटाई
§ 3. अयस्क लाभकारी
§ 4. लौह अयस्कों और सांद्रणों का एकत्रीकरण
§ 5. छर्रों का उत्पादन
अध्याय III. ब्लास्ट फर्नेस संरचना
§ 1. मेरा और ब्लास्ट फर्नेस चूल्हा
§ 2. शीर्ष डिवाइस
§ 3. चार्ज को ब्लास्ट फर्नेस में डालना
§ 4. ब्लास्ट फर्नेस का स्वचालन
§ 5. कच्चा लोहा और धातुमल डालना
§ 6. भरने वाली मशीनें
§ 7. भट्ठी में वायु प्रवाह की आपूर्ति करना और उसे गर्म करना
§ 8. ब्लास्ट फर्नेस गैस का शुद्धिकरण
अध्याय चतुर्थ. डोमेन प्रक्रिया
§ 1. ब्लास्ट फर्नेस में सामग्री का संचलन
§ 2. आवेश का गर्म होना
§ 3. नमी और वाष्पशील पदार्थों को हटाना
§ 4. कार्बन डाइऑक्साइड यौगिकों का अपघटन
§ 5. लौह आक्साइड की कमी
§ 6. सिलिकॉन की कमी और सिलिकॉन कास्ट आयरन का गलाना
§ 7. मैंगनीज की कमी और मैंगनीज कच्चा लोहा गलाना
§ 8. ब्लास्ट फर्नेस में कच्चा लोहा और स्लैग का निर्माण
§ 9. फास्फोरस का व्यवहार
§ 10. सल्फर का व्यवहार
§ 11. ब्लास्ट फर्नेस के चूल्हे में ईंधन दहन की प्रक्रियाएँ
§ 12. ब्लास्ट फर्नेस प्रक्रिया को तेज करने के तरीके
§ 13. ब्लास्ट फर्नेस उत्पाद
§ 14. ब्लास्ट फर्नेस प्रक्रिया के तकनीकी और आर्थिक संकेतक
अध्याय V. लोहे का प्रत्यक्ष उत्पादन
§ 1. एक मोटी परत में गैस द्वारा अपचयन
§ 2. ठोस कार्बन के साथ कमी
धारा दो. इस्पात धातुकर्म
§1. इस्पात वर्गीकरण
अध्याय VI. इस्पात उत्पादन के भौतिक-रासायनिक बुनियादी सिद्धांत
§ 1. इस्पात धातु विज्ञान के अध्ययन में प्रयुक्त भौतिक रसायन विज्ञान पर सामान्य जानकारी
§ 2. इस्पात निर्माण प्रक्रियाओं से निकलने वाला स्लैग
§ 3. इस्पात निर्माण प्रक्रियाओं की मूल प्रतिक्रियाएँ
अध्याय सातवीं. कन्वर्टर्स में स्टील का उत्पादन
§ 1. बेसेमर और थॉमस स्टील उत्पादन का संक्षिप्त विवरण
§ 2. ऑक्सीजन कनवर्टर प्रक्रिया का सार
§ 3. टॉप ब्लोइंग के साथ ऑक्सीजन-कन्वर्टर प्रक्रिया
§ 4. दूध उड़ाने के साथ ऑक्सीजन-कनवर्टर प्रक्रिया
§ 5. संयुक्त ब्लोइंग के साथ कनवर्टर प्रक्रिया
§ 6. उच्च-फॉस्फोरस कच्चा लोहा का कनवर्टर प्रसंस्करण
§ 7. ऑक्सीजन-कनवर्टर गैसों का शुद्धिकरण
§ 8. पिघलने का नियंत्रण और प्रक्रिया स्वचालन
§ 9. स्टील की गुणवत्ता और ऑक्सीजन कनवर्टर प्रक्रिया के तकनीकी और आर्थिक संकेतक
§ 10. ऑक्सीजन कनवर्टर दुकानों का निर्माण
इसमें आपकी भी रुचि हो सकती है:
अध्याय आठ. खुली चूल्हा भट्टियों में इस्पात का उत्पादन
§ 1. खुली चूल्हा प्रक्रिया के विकास का इतिहास
§ 2. खुली चूल्हा प्रक्रिया का सार
§ 3. खुली चूल्हा भट्टी का निर्माण
§ 4. खुली चूल्हा भट्टी का तापीय कार्य और ईंधन
§ 5. खुली चूल्हा प्रक्रिया की किस्में
§ 6. मुख्य खुली चूल्हा प्रक्रिया और इसकी किस्में
§ 7. एसिड ओपन-चूल्हा प्रक्रिया
§ 8. खुली चूल्हा प्रक्रिया के तकनीकी और आर्थिक संकेतक
§ 9. डबल-बाथ स्टील-गलाने वाली भट्टियां
अध्याय IX. विद्युत भट्टियों में इस्पात का उत्पादन
§ 1. इलेक्ट्रिक आर्क भट्टियों का निर्माण
§ 2. मुख्य इलेक्ट्रिक आर्क फर्नेस में स्टील को पिघलाना
§ 3. अम्लीय विद्युत भट्टी में पिघलना
§ 4. प्रेरण भट्टियां और उनमें गलाना
अध्याय X. स्टील और मिश्र धातुओं के उत्पादन में वैक्यूम का अनुप्रयोग
§ 1. वैक्यूम भट्टियों में इस्पात बनाना
§ 2. निर्वात में तरल इस्पात का प्रसंस्करण
§ 3. विद्युत धातुकर्म की विशेष विधियाँ
अध्याय XI. इस्पात में ढली हुई वस्तु
§ 1. ऊपर से स्टील की ढलाई
§ 2. साइफन द्वारा स्टील की ढलाई
§ 3. स्टील कास्टिंग के लिए उपकरण
§ 4. कास्टिंग तकनीक
§ 5. यूएनआरएस में स्टील कास्टिंग
§ 6. उबलते, शांत और अर्ध-शांत स्टील की अवधारणा
§ 7. स्टील सिल्लियों की संरचना
§ 8. स्टील सिल्लियों की रासायनिक विविधता और दोष
अध्याय XII. लौहमिश्र धातु उत्पादन
§1. लौहमिश्र भट्टियों का डिज़ाइन
§2. फेरोसिलिकॉन उत्पादन तकनीक
§3. फेरोमैंगनीज कार्बन का उत्पादन
§4. कार्बन फेरोक्रोम का उत्पादन
§5. फेरोटिटेनियम के उत्पादन के लिए मेटालोथर्मिक विधि
धारा तीन. धातु का गठन
अध्याय XIII. प्लास्टिक विरूपण और बुनियादी रोलिंग सिद्धांत
§1. बल और तनाव
§2. तनाव स्थिति आरेख और विरूपण आरेख
§3. प्लास्टिसिटी समीकरण
§4. गर्म और ठंडी अवस्था में धातुओं और मिश्रधातुओं का प्लास्टिक विरूपण
§5. प्लास्टिक क्रिस्टलीय पिंडों के आकार में परिवर्तन करता है
§6. असमान विकृति
§7. धातु की मात्रा और विरूपण गुणांक की स्थिरता
§8. विस्थापन
§9. न्यूनतम प्रतिरोध का नियम
§10. रोलिंग सिद्धांत की मूल बातें
§ग्यारह। रोल द्वारा धातु कैप्चर करने की शर्त
§12. रोलिंग के दौरान घर्षण की भूमिका. प्लास्टिक विरूपण के दौरान घर्षण का गुणांक
§13. विरूपण की डिग्री और घर्षण गुणांक पर रोल के कामकाजी व्यास की निर्भरता
§14. रोलिंग विस्तार
§15. लुढ़कते समय आगे बढ़ें
§16. रोलिंग बल
§17. रोल और रोलिंग क्षण पर कार्य करने वाले बलों की दिशा
§18. रोलिंग बल का प्रायोगिक निर्धारण
अध्याय XIV. उपकरणों को रोल करने और गर्म करने से पहले धातु को गर्म करना
§1. रोलिंग से पहले स्टील का ताप तापमान
§2. धातु तापन दर
§3. रोलिंग के अंत में धातु का तापमान
§4. रोल करने के बाद स्टील को ठंडा करना
§5. तापन भूल गया
§6. वर्कपीस का ताप
अध्याय XV. रोलिंग मिलों के मुख्य और सहायक उपकरण
§1. रोलिंग मिल की मुख्य लाइन
§2. रोलिंग मिलों का वर्गीकरण
§3. रोलिंग मिलों के कार्यशील स्टैंडों का वर्गीकरण
§4. रोलिंग मिल की मुख्य लाइन के उपकरण
§5. रोलिंग मिलों के लिए सहायक उपकरण
अध्याय XVI. रोलिंग तकनीक
§1. रोलिंग के लिए सिल्लियां और बिलेट्स तैयार करना
§ 2. रोल का अंशांकन
§ 3. प्रक्रिया नियंत्रण
§ 4. धातुकर्म संयंत्र में रोलिंग उत्पादन की तकनीकी योजनाएँ
§ 5. ब्लूम उत्पादन
§ 6. रिक्त स्थान का उत्पादन
§ 7. बड़े ग्रेड स्टील का उत्पादन
§ 8. मध्यम श्रेणी के स्टील का उत्पादन
§ 9. छोटे ग्रेड स्टील का उत्पादन
§ 10. वायर रॉड का उत्पादन
§ 11. रेल और बीम का उत्पादन
§ 12. विशेष प्रयोजन मिलें
§ 13. लंबी रोलिंग मिलों के संचालन के तकनीकी और आर्थिक संकेतक
§ 14. प्लेट स्टील का उत्पादन
§ 15. चौड़ी पट्टी वाले स्टील का उत्पादन
§ 16. कोल्ड-रोल्ड शीट और स्ट्रिप्स का उत्पादन
§ 17. धातु पाउडर से रोल्ड उत्पादों का उत्पादन
§ 18. शीट रोलिंग मिलों के तकनीकी और आर्थिक संकेतक
अध्याय XVII. सीमलेस और वेल्डेड पाइप का उत्पादन
§ 1. सीमलेस पाइप का उत्पादन
§ 2. स्वचालित मिल पर पाइप का उत्पादन
§ 3. सतत मिल पर पाइपों का उत्पादन
§4. कोल्ड रोल्ड पाइप का उत्पादन
§ 5. सतत भट्टी वेल्डिंग द्वारा पाइपों का उत्पादन
§ 6. विद्युत वेल्डेड पाइपों का उत्पादन
अध्याय XVIII. ड्राइंग उत्पादन
§ 1. ड्राइंग के सिद्धांत के मूल सिद्धांत
§ 2. घसीटना
§ 3. ड्राइंग के दौरान स्नेहन
§ 4. तार उत्पादन की तकनीकी प्रक्रिया
§ 5. तार खींचने वाली मशीनें
रूसी संघ के शिक्षा और विज्ञान मंत्रालय
शिक्षा के लिए संघीय एजेंसी
साउथ यूराल स्टेट यूनिवर्सिटी
ज़्लाटौस्ट में शाखा
सामान्य धातुकर्म विभाग
669. 02/ . 09 (07)
डी463
धातुकर्म प्रक्रियाओं का सिद्धांत
ट्यूटोरियल
चेल्याबिंस्क
एसयूएसयू पब्लिशिंग हाउस
परिचय
धातुकर्म प्रक्रियाएं धातुकर्म इकाइयों (ब्लास्ट फर्नेस, सिंटरिंग मशीन) में होने वाली भौतिक घटनाओं और भौतिक और रासायनिक परिवर्तनों (गैसों, तरल और ठोस पदार्थों की गति, गर्मी और द्रव्यमान स्थानांतरण, चरण संक्रमण, ऑक्सीकरण और सामग्री की कमी आदि) का एक समूह हैं। , उच्च तापमान पर इस्पात बनाने और हीटिंग भट्टियां, कनवर्टर)। पाठ्यक्रम "धातुकर्म प्रक्रियाओं का सिद्धांत" के अध्ययन का विषय निर्दिष्ट धातुकर्म इकाइयों में होने वाली प्रतिक्रियाएं हैं।
टीएमपी पाठ्यक्रम सभी धातुकर्म विषयों के बीच एक विशेष स्थान रखता है; वास्तव में, यह कच्चा लोहा, इस्पात और लौह मिश्र धातु के उत्पादन के दौरान होने वाली घटनाओं के विश्लेषण के संबंध में लागू भौतिक रसायन विज्ञान है।
धातुकर्म प्रक्रियाओं की सैद्धांतिक नींव को एक निश्चित क्रम में माना जाता है: सबसे पहले, थर्मोडायनामिक्स के नियमों के आधार पर, रासायनिक प्रक्रियाओं की संतुलन स्थितियों का विश्लेषण किया जाता है, फिर प्रक्रियाओं के तंत्र की गतिकी और विशेषताओं का विश्लेषण किया जाता है। ये प्रश्न टीएमपी पाठ्यक्रम का अध्ययन करते समय हल किए जाने वाले मुख्य कार्य हैं।
1. उच्च तापमान गैस की संरचना और गुण वायुमंडल
1.1. गैस वायुमंडल की ऊष्मप्रवैगिकी
धातुकर्म पिघल (लोहा, इस्पात, मिश्र धातु) के उत्पादन के लिए पाइरोमेटालर्जिकल प्रक्रियाएं गैस वायुमंडल की भागीदारी के साथ होती हैं, जो तटस्थ, ऑक्सीकरण और कम करने वाली हो सकती हैं।
गैस चरण की संरचना, दबाव और तापमान धातुओं और मिश्र धातुओं के उत्पादन के दौरान बने अन्य चरणों के साथ इसकी बातचीत की प्रकृति पर निर्भर करता है। इस मामले में, गैस चरण की मध्यवर्ती और पूर्ण संरचना दोनों बहुत समान हैं:
ऑक्सीजन के साथ तत्वों की पूर्ण अंतःक्रिया के उत्पाद - CO2, H2O (भाप), SO3;
ऑक्सीजन के साथ अपूर्ण अंतःक्रिया, ऑक्साइड के पृथक्करण और धातुओं के विघटन के उत्पाद - CO, SO2, H2, O2, N2, CH4; अक्रिय गैसें - Ar, Kr.
गैस चरण की संतुलन संरचना की गणना रासायनिक प्रतिक्रियाओं के थर्मोडायनामिक विश्लेषण के आधार पर की जा सकती है, जिनमें से सबसे महत्वपूर्ण ऑक्सीजन के साथ हाइड्रोजन, कार्बन मोनोऑक्साइड, मीथेन और सल्फर डाइऑक्साइड की प्रतिक्रियाएं हैं।
इन प्रतिवर्ती प्रतिक्रियाओं को निम्नलिखित रासायनिक समीकरणों (प्रति 1 मोल O2) द्वारा वर्णित किया गया है:
2H2 + O2 = 2H2O(भाप), | जे; | |
2СО + O2 = 2СО2, | जे; | |
2СH4 + O2 = 2СО + 4H2O, | जे; | |
1/2СH4 + O2 = 1/2СО2 + Н2О, | जे; | (1.4) |
2SO2 + O2 = 2SO3, | जे। |
इन प्रतिवर्ती प्रतिक्रियाओं का थर्मोडायनामिक विश्लेषण संतुलन सामग्री और आणविक ऑक्सीजन के आंशिक दबाव को स्थापित करना संभव बनाता है, साथ ही इन प्रतिक्रियाओं में गैस चरण के रेडॉक्स गुणों को चिह्नित करना भी संभव बनाता है।
हालाँकि, एक अधिक महत्वपूर्ण थर्मोडायनामिक विशेषता, जो रासायनिक प्रतिक्रियाओं की दिशा निर्धारित करती है, गिब्स ऊर्जा डी जीटी में परिवर्तन है, जिसका मानक परिवर्तन डी जी ° टी, प्रतिक्रियाओं के लिए तापमान पर निर्भर करता है (1.1)-(1.5) का रूप है , जे:
डी जी° (1.1) = - + 108 टी;
डी जी° (1.2) = - + 175 टी;
डी जी° (1.3) = - + 370 टी;
डी जी° (1.4) = - + 2 टी;
डी जी° (1.5) = - + 196 टी।
चित्र में. 1.1 इन निर्भरताओं के ग्राफ़ दिखाता है।

चावल। 1.1. दहन प्रतिक्रियाओं के लिए मानक गिब्स ऊर्जा
ये निर्भरताएँ 2500 K तक के तापमान और सिस्टम में कुल दबाव P = 1 atm पर मान्य हैं, यानी, परमाणुओं में H2O, O2, H2 के पृथक्करण, उनके आयनीकरण और प्लाज्मा गठन की प्रक्रियाओं से पहले।
चित्र में D G° Т = f(T) के रूप में दी गई निर्भरता और ग्राफ़ के विश्लेषण से। 1.1 से यह निष्कर्ष निकलता है कि बढ़ते दबाव के साथ प्रतिक्रियाओं (1.1), (1.2) और (1.5) का संतुलन आगे की दिशा में बदल जाता है, और बढ़ते तापमान के साथ इन प्रतिक्रियाओं की पूर्णता कम हो जाती है। दबाव में परिवर्तन प्रतिक्रिया के संतुलन (1.4) को प्रभावित नहीं करता है, और प्रतिक्रिया का सीधा कोर्स (1.3) बढ़ते दबाव के साथ धीमा हो जाता है। बढ़ते तापमान के साथ, प्रतिक्रियाओं (1.3) और (1.4) की घटना की अधिक पूर्णता की विशेषता होती है।
परिणामी वायुमंडल की संतुलन संरचना और इसके घटक घटकों के आंशिक दबाव से ऑक्सीकरण या कटौती में सक्षम विषम प्रणाली की सामग्रियों को प्रभावित करने वाले गैस चरण के रेडॉक्स गुणों (ओआरपी) को निर्धारित और गणना करना संभव हो जाएगा।
किसी भी गैस मिश्रण के ROM की सबसे सरल मात्रात्मक विशेषता ऑक्सीजन का संतुलन आंशिक दबाव है। हालाँकि, गैस वायुमंडल के ROM का अधिक सटीक आकलन इसकी ऑक्सीजन क्षमता pO है, जो मानक अवस्था से मापा जाने पर आणविक ऑक्सीजन की रासायनिक क्षमता का मूल्य है, जिस पर DIV_ADBLOCK144">
पी ओ का मान तापमान और गैस चरण की संरचना पर निर्भर करता है, जिसे प्रभावित करने वाले अभिकर्मकों के आंशिक दबाव के अनुपात के माध्यम से व्यक्त किया जाता है।
धातुकर्म इकाइयों में, गैस वायुमंडल में कई घटक होते हैं जो लगातार भौतिक रासायनिक परिवर्तनों में शामिल होते हैं। ऐसी प्रणालियों का थर्मोडायनामिक विश्लेषण इस कथन पर आधारित है कि सिस्टम में सभी संभावित आंशिक संतुलन की एक साथ स्थापना के परिणामस्वरूप एक जटिल रासायनिक संतुलन प्राप्त होता है।
इस प्रकार, जब प्रतिक्रियाएँ (1.1)-(1.5) गैस चरण में T=const पर एक साथ होती हैं, तो संकेतित घटकों का दबाव संतुलन स्थिरांक KR(1.1)-KR(1.5) के अनुरूप मान लेगा, और गैस मिश्रण की ऑक्सीजन क्षमता
इनमें से किसी भी संतुलन के डेटा से गणना की जा सकती है, उदाहरण के लिए, समीकरण से
विचाराधीन आठ-घटक गैस मिश्रण में, प्रतिक्रियाओं (1.1)-(1.5) के अलावा, अभिकर्मकों के बीच अन्य रासायनिक बातचीत संभव है। सबसे बड़ी रुचि तथाकथित जल गैस प्रतिक्रिया है (जल गैस चार गैसों H2 - H2O - CO - CO2 का मिश्रण है):
H2 + CO2 = H2O + CO, D G° (1.5) = - 33.5T J. (1.8)
ब्लास्ट फर्नेस और अन्य धातुकर्म इकाइयों में प्राकृतिक गैस या आर्द्रीकृत विस्फोट का उपयोग करते समय गैस वायुमंडल में संतुलन का आकलन करने के लिए धातु विज्ञान में इस प्रतिक्रिया का विश्लेषण बेहद महत्वपूर्ण है।
प्रतिक्रिया प्रणाली (1.8) की संतुलन संरचना निर्धारित करने के लिए, न केवल संतुलन स्थिरांक का मान निर्दिष्ट करना आवश्यक है
 (1.9)
(1.9)
और सामान्य दबाव
(1.10)
लेकिन दो अन्य स्थितियों से भी, जो स्वतंत्रता की डिग्री की संख्या के विश्लेषण से उत्पन्न होती हैं:
सी = पी + 2 - एफ = 3 + 2 - 1 = 4.
व्यवहार में, सिस्टम की प्रारंभिक संरचना या प्रारंभिक मिश्रण में आंशिक वाष्प दबाव को अक्सर निर्दिष्ट किया जाता है। हमारे मामले में, पी और टी के अलावा, दो चर के रूप में हम कार्बन और हाइड्रोजन के मोल्स की अपरिवर्तनीय संख्या या हाइड्रोजन और कार्बन युक्त गैसों के आंशिक दबावों के अपरिवर्तनीय योग चुन सकते हैं:
 (1.11)
(1.11)
 (1.12)
(1.12)
समीकरण (1.9)-(1.12) का संयुक्त समाधान हमें गैस मिश्रण की संतुलन संरचना खोजने की अनुमति देता है। गणना के परिणाम ग्राफ़िक रूप से प्रस्तुत किए जा सकते हैं, प्रारंभिक डेटा निम्नलिखित अनुपात वाले होंगे:
 (1.13)
(1.13)
ग्राफ़ से (चित्र 1..gif" width='69' ऊंचाई='28'> और इसके विपरीत। %CO / %CO2 (या %H2 / %H2O) के संतुलन मान की गणना करने के बाद, आप निर्धारित कर सकते हैं CO - CO2 - सिस्टम H2 - H2O की ऑक्सीजन क्षमता और चित्र 1.2 में स्थिर p O मानों की प्लॉट रेखाएँ।

चावल। 1.2. %CO के बीच संबंध/ %CO2 और %H2 / %H2O.
1.2. सजातीय गैस प्रक्रियाएं
जटिल गैस वायुमंडल में होने वाली प्रतिक्रियाओं का थर्मोडायनामिक विश्लेषण केवल आगे या विपरीत दिशाओं में होने वाली प्रतिक्रिया की संभावना का न्याय करने और गैस चरण की संरचना की गणना करने की अनुमति देता है। हालाँकि, अंतःक्रिया प्रक्रियाओं के तंत्र पर विचार करना और उनका गतिज विश्लेषण करना असंभव है।
संयोजकता-संतृप्त अणुओं की परस्पर क्रिया की क्रियाविधि में संयोजकता बंधों का टूटना या कमजोर होना अवश्य शामिल होना चाहिए। इसके लिए बड़ी ऊर्जा लागत की आवश्यकता होती है, जिसकी भरपाई केवल अणुओं की तापीय गति की ऊर्जा से नहीं की जा सकती। जैसा कि प्रयोगात्मक आंकड़ों से पता चलता है, सभी दहन प्रतिक्रियाओं में एक श्रृंखला तंत्र होता है, जो सक्रिय केंद्रों (कणों) - परमाणुओं और मुक्त वैलेंस वाले रेडिकल्स की भागीदारी की विशेषता है। बहु-चरण ऑक्सीकरण प्रक्रिया का सबसे सरल कार्य सक्रिय केंद्रों के गठन के बाद शुरू होता है और उनके और कम गतिविधि ऊर्जा वाले अणुओं के बीच रासायनिक प्रतिक्रियाओं के रूप में आगे बढ़ता है। ऐसी प्रतिक्रियाओं की एक विशेषता सक्रिय केंद्रों का पुनरुत्पादन है। उनके पाठ्यक्रम की प्रकृति के अनुसार, श्रृंखला प्रतिक्रियाओं को अशाखित, शाखित और पतित शाखाओं में विभाजित किया जाता है।
सामान्य तौर पर, श्रृंखला प्रतिक्रियाओं के सिद्धांत में मॉडल हाइड्रोजन दहन की सबसे अधिक अध्ययन की जाने वाली प्रतिक्रिया है, जो कि छोटी संख्या में मध्यवर्ती उत्पादों और अच्छी तरह से पहचाने गए प्राथमिक कृत्यों की विशेषता है। वे हैं:
1) मिश्रण की मात्रा और बर्तन की दीवार पर सक्रिय केंद्रों के निर्माण की प्रतिक्रियाएँ:
![]()
![]() ई1.14 = 198.55 केजे/मोल; (1.14)
ई1.14 = 198.55 केजे/मोल; (1.14)
![]()
![]() ई1.15 = 180.7 केजे/मोल; (1.15)
ई1.15 = 180.7 केजे/मोल; (1.15)
Nads + O2 = HO2; (1.16)
2) श्रृंखला निरंतरता प्रतिक्रिया:
https://pandia.ru/text/79/398/images/image020_45.gif" width=”172” ऊंचाई=”48 src=”> E1.17=41.9 kJ/mol; (1.17)
3) शृंखला शाखा अभिक्रियाएँ:
![]()
![]() ई1.18 = 63.27 केजे/मोल; (1.18)
ई1.18 = 63.27 केजे/मोल; (1.18)
![]()
![]() ई1.19 = 25.14 केजे/मोल; (1.19)
ई1.19 = 25.14 केजे/मोल; (1.19)
4) दीवार पर सर्किट टूटने (निष्क्रिय) की प्रतिक्रिया
![]()
![]() ; (1.20)
; (1.20)
5) गैस चरण की मात्रा में श्रृंखला समाप्ति प्रतिक्रिया (एम एक तटस्थ अणु है):
![]() ई(1.21) » 0; डी एच1.20 = - 197 केजे/मोल। (1.21)
ई(1.21) » 0; डी एच1.20 = - 197 केजे/मोल। (1.21)
इनमें से प्रत्येक प्रतिक्रिया की दर आंशिक दबाव पी और प्रतिक्रिया क्रम एन द्वारा निर्धारित की जाती है और सामान्य तौर पर इसे इस प्रकार दर्शाया जा सकता है
वी = स्थिरांक × https://pandia.ru/text/79/398/images/image029_30.gif" width=”411 ऊंचाई=267” ऊंचाई=”267”>
चावल। 1.3. गैस मिश्रण के प्रज्वलन की शर्तें (H2 + O2)
2. ठोस कार्बन दहन प्रक्रियाओं का विश्लेषण
ऑक्सीकरण एजेंटों के साथ कार्बन की संभावित अंतःक्रियाओं में से, हम सबसे महत्वपूर्ण पर विचार करेंगे।
1. कार्बन के अपूर्ण दहन की प्रतिक्रिया
2C + O2 = 2CO, D G° T(2.1) = - - 180T J/mol। (2.1)
2. पूर्ण दहन प्रतिक्रिया
सी + ओ2 = सीओ2, डी जी° टी(2.2) = - - 2.3टी जे/मोल। (2.2)
3. कार्बन गैसीकरण की भाप H2O से CO में प्रतिक्रिया
2C + 2H2O = 2CO + 2H2, D G° T(2.3) = - 288T J/mol। (2.3)
4. भाप H2O से CO2 तक कार्बन गैसीकरण की प्रतिक्रिया
C + 2H2O = CO2 + 2H2, D G° T(2.4) = - 110.6 T J/mol। (2.4)
5. कार्बन गैसीकरण प्रतिक्रिया
C + CO2 = 2CO, D G° T(2.5) = - 177.7T J/mol। (2.5)
सबसे बड़ी रुचि प्रतिक्रिया (2.5) है, जो एंडोथर्मिक है: डी Н° = 172.6 केजे।
अनुपात से, जो कार्बन गैसीकरण प्रतिक्रिया द्वारा स्थापित किया जाता है, कोई विस्तृत तापमान सीमा पर सी-सीओ-सीओ2 प्रणाली के गैस चरण की संरचना पर ठोस कार्बन के प्रभाव का अनुमान लगा सकता है। इस गैस वायुमंडल की संतुलन संरचना चित्र में दिखाई गई है। 2.1.
ले चैटेलियर के सिद्धांत के अनुसार, दबाव में वृद्धि कार्बन गैसीकरण प्रतिक्रिया के संतुलन को बाईं ओर स्थानांतरित कर देती है, अर्थात, एक स्थिर तापमान पर, संतुलन गैस मिश्रण CO2 डाइऑक्साइड से समृद्ध होता है। जैसे-जैसे दबाव कम होता है, गैस चरण में CO की सांद्रता बढ़ती है।
ऑक्सीकरण एजेंट के साथ कार्बन की परस्पर क्रिया की विषम प्रक्रिया में कई चरण होते हैं:
2) डीजी मोटाई की एक हाइड्रोडायनामिक परत के माध्यम से आणविक प्रसार, जहां लामिना का प्रवाह बनाए रखा जाता है;
3) कार्बन सतह पर ऑक्सीकरण एजेंट का सोखना;
4) अधिशोषित उत्पादों के निर्माण के साथ रासायनिक अंतःक्रिया (कम तापमान पर CO2 और उच्च तापमान पर CO);
5) प्रतिक्रिया उत्पादों का अवशोषण;
6) गैस प्रवाह में प्रतिक्रिया उत्पादों का प्रसार (आण्विक और अशांत)।

चावल। 2.1. गैस वायुमंडल की संरचना (CO- CO2) ठोस कार्बन के साथ संतुलन में है
कार्बन ऑक्सीकरण की प्रक्रिया में सीमित चरण सोखना-गतिज चरण है, जो चरण 3, 4 और 5 को जोड़ता है। आणविक प्रसार भी सीमित हो सकता है।
प्रति इकाई सतह क्षेत्र में प्रसार दर की गणना सूत्र का उपयोग करके की जा सकती है
![]() (2.6)
(2.6)
जहां डी प्रसार गुणांक है, बी द्रव्यमान स्थानांतरण गुणांक है, सीओ और स्पोव क्रमशः गैस चरण की मात्रा और कार्बन सतह पर ऑक्सीडाइज़र की एकाग्रता हैं।
रासायनिक अंतःक्रिया की दर अधिशोषित अभिकर्मक स्पोव की सांद्रता से निर्धारित होती है:
![]() (2.7)
(2.7)
जहां K प्रतिक्रिया दर स्थिरांक है, जो प्रक्रिया की सक्रियण ऊर्जा के तापमान पर तेजी से निर्भर करता है, n प्रतिक्रिया का क्रम है (इस मामले में n = 1)।
यदि गैस चरण के साथ कार्बन के संपर्क की प्रक्रिया एक स्थिर मोड में होती है, यानी, समय के साथ गति को बदले बिना, तो इस प्रक्रिया की दर Vperc के रूप में निर्धारित की जाती है
वीप्रोट = वी एक्स। पी = वीडी. (2.8)
संबंधों (2.6) और (2.7) को (2.8) में प्रतिस्थापित करने पर, हम अंततः कार्बन ऑक्सीकरण प्रक्रिया की देखी गई दर प्राप्त करते हैं:
 (2.9)
(2.9)
K और b मानों के अनुपात के आधार पर, निम्नलिखित ऑक्सीकरण मोड संभव हैं:
– b >>K पर गतिज;
– K>>b पर प्रसार;
– प्रसार-गतिज पर K » बी.
प्रतिक्रिया का थर्मोडायनामिक विश्लेषण (2.5) हमें कार्बन मोनोऑक्साइड के अपघटन के लिए स्थितियों की पहचान करने की अनुमति देता है। यह गैस वायुमंडल में उच्च अनुपात और कम तापमान पर संभव है। प्रतिक्रिया के लिए मान D G° T
2CO = CO2 + C
घटते तापमान के साथ घटता जाता है, लेकिन उत्प्रेरक के बिना, उदाहरण के लिए, सीमेंटीकरण की प्रक्रिया में, इस प्रतिक्रिया को गतिज रूप से करना मुश्किल होता है।
CO अणु में "C - O" बंधन को ऑक्सीकरण करने के लिए, एक उत्प्रेरक ठोस सतह की आवश्यकता होती है; सबसे शक्तिशाली उत्प्रेरक लोहा है। इस मामले में, ठोस बारीक परिक्षिप्त कार्बन के निर्माण के साथ CO अपघटन की प्रक्रिया के मुख्य चरण निम्नलिखित होंगे:
1) उत्प्रेरक की सतह पर सीओ अणु का सोखना, जिससे "सी-ओ" बंधन कमजोर हो जाता है;
2) प्रतिक्रिया द्वारा अधिशोषित गैस चरण के एक सक्रिय CO अणु के प्रभाव पर अपघटन की प्रक्रिया
CO + Soads = CO2 + C.
3. रासायनिक यौगिकों की ताकत का आकलन
धातु विज्ञान के लिए सबसे महत्वपूर्ण यौगिकों - ऑक्साइड, नाइट्राइड, कार्बोनेट - के पृथक्करण की प्रक्रियाएँ बहुत महत्वपूर्ण हैं, क्योंकि वे धातु प्राप्त करने का एक सीधा तरीका हैं। ये प्रक्रियाएँ बहुत समान हैं, और तापमान के आधार पर इन्हें निम्न प्रकार के समीकरणों द्वारा दर्शाया जा सकता है:
एबीटीवी = एटीवी + वीजीएएस;
एबीटीवी = अल + वीगास;
एबीज़ह = एटीवी + वीगैस;
АВж = Аж + Вगैस।
इन अभिक्रियाओं के गैसीय उत्पाद के संतुलन आंशिक दबाव के मान को कहा जाता है पृथक्करण की लोचकनेक्शन एबी और इस कनेक्शन की ताकत को दर्शाता है। पृथक्करण प्रतिक्रियाएं एंडोथर्मिक होती हैं, यानी, बढ़ते तापमान के साथ, संतुलन प्रतिक्रिया उत्पादों की ओर स्थानांतरित हो जाता है। गैस चरण की संरचना को बनाए रखते हुए दबाव कम करने से एक समान प्रभाव पड़ता है।
गिब्स चरण नियम के अनुसार, पृथक्करण प्रतिक्रियाओं के लिए स्वतंत्रता की डिग्री की संख्या इस प्रकार निर्धारित की जाती है
सी = के + 2 - एफ = 2 + 2 - 3 = 1,
अर्थात्, एक मात्रात्मक विशेषता के लिए, केवल एक स्वतंत्र पैरामीटर पर्याप्त है - तापमान, जिस पर प्रक्रिया का संतुलन स्थिरांक निर्भर करता है:
क्र = РВ = ¦ (टी)।

चावल। 3.1. तापमान पर यौगिक एबी के पृथक्करण की लोच की निर्भरता
चित्र में. चित्र 3.1 संकेतित प्रतिक्रियाओं के लिए तापमान पर आरटी की निर्भरता दर्शाता है।
3.1. कार्बोनेट्स का पृथक्करण
लौह धातु विज्ञान में, सबसे बड़ी व्यावहारिक रुचि कैल्शियम कार्बोनेट CaCO3, मैग्नीशियम MgCO3, मैंगनीज MnCO3, लौह FeCO3 (साइडराइट) और डोलोमाइट CaMg(CO3)2 की पृथक्करण प्रतिक्रिया का विश्लेषण है। इन यौगिकों की पृथक्करण प्रक्रियाएँ एक ही प्रकार की होती हैं और समीकरण के अनुसार आगे बढ़ती हैं:
मीको 3 = मीओ + सीओ 2,
मूल्य कार्बोनेट पृथक्करण की लोच है और यौगिक की रासायनिक शक्ति के माप को दर्शाता है।
सबसे बड़ी रुचि कैल्शियम कार्बोनेट की पृथक्करण प्रतिक्रिया है, जो ब्लास्ट फर्नेस और स्टील निर्माण उत्पादन की चार्ज सामग्री का हिस्सा है, और इसका उपयोग चूना पत्थर भूनने के माध्यम से सीएओ का उत्पादन करने के लिए भी किया जाता है।
CaCO3 पृथक्करण प्रतिक्रिया को फॉर्म के समीकरण द्वारा वर्णित किया गया है
सीएसीओ 3 = सीएओ टीवी + सीओ 2, = जे; (3.1)
डी जी ° टी = - 150 टी; केपी(3.1) =
तापमान पर कार्बोनेट पृथक्करण की लोच की निर्भरता चित्र में दिखाई गई है। 3.2.

चावल। 3.2. CaCO3 का पृथक्करण लोच
रासायनिक प्रतिक्रिया इज़ोटेर्म का उपयोग करके इस ग्राफिकल निर्भरता के विश्लेषण से पता चलता है कि कार्बोनेट पृथक्करण तब संभव है जब वास्तविक मूल्य संतुलन मूल्य से कम हो और साथ ही डी जी ° टी< 0. Температура, при которой возможен этот процесс, является температурой начала диссоциации ТНД.
चित्र में संतुलन रेखा के ऊपर कोई भी आलंकारिक बिंदु 1। 3.2 कार्बोनेट CaCO3 के स्थिर अस्तित्व से मेल खाता है। रेखा के नीचे कोई भी आलंकारिक बिंदु 2 CaO ऑक्साइड के स्थिर अस्तित्व से मेल खाता है।
कार्बोनेट पृथक्करण की प्रक्रिया टीसीए के रासायनिक क्वथनांक से ऊपर के तापमान पर उच्च दर पर होती है, जिस पर पृथक्करण की लोच गैस चरण के कुल बाहरी दबाव के बराबर हो जाती है।
3.2. लौह आक्साइड का पृथक्करण
ऑक्साइड पृथक्करण की प्रक्रियाओं की थर्मोडायनामिक्स कार्बोनेट पृथक्करण की प्रक्रिया के समान है; विशेषताएं केवल कुछ धातुओं में वैलेंस की विभिन्न डिग्री की उपस्थिति से जुड़ी होती हैं - विशेष रूप से, लौह ऑक्साइड।
बैकोव के सिद्धांत के अनुसार, लोहे के आक्साइड का पृथक्करण धातु के निर्माण तक, उच्चतम से निम्नतम तक क्रमिक रूप से होता है। पृथक्करण प्रतिक्रियाओं के निम्नलिखित रूप हैं:
6Fe2O3 = 4Fe3O4 + O2, D G ° T = - 281.3 T J; (3.2)
2Fe3O4 = 6FeO + O2, D G ° T = - 250.2 T J; (3.3)
2FeO = Fe + O2, D G ° T = - 130.7 T J; (3.4)
1/2Fe 3O 4 = 3/2Fe + O 2, D G° T = - 160.2 T J. (3.5)
ये ऑक्साइड निश्चित तापमान सीमाओं में मौजूद होते हैं। चित्र में. चित्र 3.3 प्रतिक्रियाओं के तापमान पर डी जी° टी की निर्भरता के ग्राफ दिखाता है (1)-(4)।

चावल। 3.3. आयरन ऑक्साइड की पृथक्करण प्रतिक्रियाओं की मानक गिब्स ऊर्जा
पृथक्करण लोच के परिकलित मूल्यों के आधार पर, निर्भरताओं का निर्माण किया गया ![]() चित्र में प्रस्तुत किया गया है। 3.4.
चित्र में प्रस्तुत किया गया है। 3.4.

चावल। 3.4. स्थायी अस्तित्व के क्षेत्र
लोहा और उसके ऑक्साइड
यह आरेख विस्तृत तापमान सीमा में शुद्ध लोहे और उसके ऑक्साइड के स्थिर अस्तित्व के क्षेत्रों को दर्शाता है। बिंदु O पैरामीटर T = 575° C और »-26 के साथ अपरिवर्तनीय संतुलन से मेल खाता है (चार चरण संतुलन में हैं - ठोस Fe, FeO, Fe3O4 और O2)। शेष रेखाओं पर, एक अपरिवर्तनीय संतुलन का एहसास होता है। रेखाओं के बीच का कोई भी बिंदु द्विचर प्रणाली की एक निश्चित स्थिति से मेल खाता है, जो किसी दिए गए संघनित चरण के स्थिर अस्तित्व के लिए शर्तों को निर्धारित करना संभव बनाता है।
3.3. पृथक्करण प्रक्रियाओं का तंत्र और गतिकी
प्रपत्र की प्रतिक्रियाओं के अनुसार होने वाली पृथक्करण प्रक्रियाओं की विशिष्ट विशेषताएं
AVtv® Atv + Vgaz,
हैं:
- एक नए ठोस चरण के न्यूक्लियेशन की प्रक्रिया की उपस्थिति;
- "पुराने" और "नए" ठोस चरणों के बीच इंटरफ़ेस पर प्रक्रिया का स्थानीयकरण;
- रूपांतरण की डिग्री पर प्रक्रिया की गति की निर्भरता।
रूपांतरण की डिग्री का उपयोग ऐसी प्रक्रिया की विशेषता के रूप में किया जाता हैए:
जहां एमएबी (पी), एमएबी (रेफरी) - यौगिक AB का संतुलन और प्रारंभिक मान।
रूपांतरण दरए प्रक्रिया समय पर निर्भर करता है, जिसकी पुष्टि कई प्रयोगात्मक डेटा (चित्र 3.5) से होती है।
फ़ॉन्ट-आकार:13.0pt;अक्षर-अंतरिक्ष:-.1pt">चित्र 3.5। रूपांतरण की डिग्री की इज़ोटेर्मल निर्भरताए समय से
और परिवर्तन की दर परिवर्तन की डिग्री से
इस मामले में, तीन चरणों को प्रतिष्ठित किया जा सकता है:
मैं - प्रेरण अवधि, एक नए चरण के निर्माण में कठिनाइयों के कारण कम प्रक्रिया दर की विशेषता;
द्वितीय - पृथक्करण प्रतिक्रिया के त्वरण से जुड़े ऑटोकैटलिसिस;
तृतीय - प्रक्रिया के पूरा होने की अवधि, जो पुराने चरण और इंटरफ़ेस की मात्रा में कमी से जुड़ी है।
पृथक्करण प्रक्रियाओं के प्रायोगिक अध्ययन से संकेत मिलता है कि ऐसी प्रक्रिया योजना के अनुसार होती है
एबीटीवी ® एटीवी× वीगैस(विज्ञापन) ® एटीवी + वीगैस।
इस मामले में, पुराने चरण की गहराई में एक नए चरण के नाभिक का निर्माण सिस्टम की गिब्स ऊर्जा में कमी के साथ होना चाहिए, जिसकी गणना समीकरण का उपयोग करके की जाती है
डी जी = डी जीवी + डी जीडब्ल्यू,
जहां डी जीवी और डी जीडब्ल्यू गिब्स ऊर्जा में कुल परिवर्तन के वॉल्यूमेट्रिक और सतही घटक हैं।
D GV और D GW के मान को इस प्रकार परिभाषित किया गया है
डीजीवी= ![]()
डी जीडब्ल्यू = एस × एस,
जहां V और S नए चरण के नाभिक का आयतन और सतह हैं, r और M नए चरण का घनत्व और आणविक भार हैं, s सतह तनाव है, m 2 और m 1 AB यौगिक की रासायनिक क्षमताएं हैं नए और पुराने चरण में.
![]()
इस संबंध के विश्लेषण से यह पता चलता है कि एम 2 और एम 1 के एक निश्चित अनुपात पर एक नए चरण का सहज गठन संभव है।
टी £ टीएनडी एम 2 ³ एम 1 पर, और इस मामले में किसी भी आकार के नाभिक की उपस्थिति थर्मोडायनामिक रूप से असंभव है।
यदि T > Tnd, तो m 2 >m 1, और D G के सूत्र में पदों के अलग-अलग चिह्न हैं, क्योंकि r बढ़ने के साथ पहला पद निरपेक्ष मान में तेजी से बढ़ता है, तो वक्र D G = f (r) की अधिकतम सीमा होती है, जिसकी स्थिति महत्वपूर्ण नाभिक के आकार को निर्धारित करती है, जिसकी वृद्धि प्रणाली की ऊर्जा में कमी के साथ होती है। कुछ शर्तों के तहत, एक नए चरण का भ्रूण थर्मोडायनामिक रूप से स्थिर हो जाता है। एबीटीवी कनेक्शन की ओवरहीटिंग की डिग्री महत्वपूर्ण नाभिक की त्रिज्या और इसकी स्थिरता दोनों को निर्धारित करती है। क्रांतिक नाभिक का आकार निर्धारित करने के लिए, एक चरम के लिए फ़ंक्शन D G = f (r) की जांच करना आवश्यक है, जिसके बाद हम प्राप्त करते हैं

मात्रा D m = m 1 - m 2 को रासायनिक संतृप्ति कहा जाता है और यह पृथक्करण प्रक्रिया की प्रेरक शक्ति है।
चित्र में. चित्र 3.6 एक नए चरण के भ्रूण के उद्भव और विकास की स्थिति को दर्शाता है।
निर्भरता के विश्लेषण से यह पता चलता है कि, अन्य सभी चीजें समान होने पर, अति ताप जितना अधिक होगा, महत्वपूर्ण नाभिक उतना ही छोटा होगा और यौगिकों के पृथक्करण की प्रक्रिया उतनी ही आसान (तेज) होगी।

चावल। 3.6. नए चरण के भ्रूण के विकास के लिए परिस्थितियाँ
इस प्रकार, एक नए माध्यम के भ्रूण का विकास नए माध्यम को बनाने वाले कणों के तापमान, समय और गतिशीलता पर निर्भर करता है। किसी विशिष्ट परिवर्तन के तंत्र का अध्ययन करने से विश्लेषणात्मक निर्भरताएं निर्धारित करना संभव हो जाता है, हालांकि, वे एक नियम के रूप में, केवल विश्लेषण किए जा रहे मामले के लिए स्वीकार्य हैं। इस मामले में, एक नए चरण के भ्रूण के "अतिव्यापी" और इसके किसी भी प्रारंभिक चरण द्वारा प्रक्रिया की सीमा से जुड़ी प्राकृतिक विकास कठिनाइयों को ध्यान में रखना आवश्यक है।
वास्तविक प्रणालियाँ बनाए गए पृथक्करण मॉडल से काफी भिन्न हो सकती हैं, जिन्हें बनाते समय निम्नलिखित विशेषताओं पर ध्यान देना चाहिए: समय के प्रारंभिक क्षण में, नाभिक की धीमी वृद्धि संभव है; चरण सीमा की प्रगति की सतही गति आयतन में प्रवेश की गति से भिन्न हो सकती है; सीमा की प्रतिक्रियाशीलता समय के साथ बदलती रहती है; उत्पादों और अभिकर्मकों की मात्रा समान नहीं हो सकती है; प्रतिवर्ती प्रतिक्रियाओं में, अस्थिर प्रतिक्रिया उत्पादों का सोखना संभव है; प्रसार अवरोध की संभावित अभिव्यक्ति; गतिज विशेषताएँ, एक नियम के रूप में, कण आकार पर निर्भर करती हैं; प्रतिक्रिया उत्पादों के माध्यम से गर्मी स्थानांतरित करने में कठिनाइयाँ हो सकती हैं।
पृथक्करण प्रक्रियाओं की कुछ सूचीबद्ध विशेषताएं लिंक को सीमित कर सकती हैं, जिनमें शामिल हैं:
1) रासायनिक परिवर्तन की दर (तथाकथित गतिज शासन);
2) कोटिंग परत (प्रसार मोड) के माध्यम से गैस प्रसार की दर;
3) मिश्रित मोड (रासायनिक परिवर्तन और प्रसार की दर की तुलनीयता);
4) कोटिंग परत के माध्यम से प्रतिक्रिया के ताप हस्तांतरण की दर।
इनमें से प्रत्येक चरण को किसी विशेष यौगिक के पृथक्करण की प्रक्रिया के संबंध में, उसकी विशेषताओं को ध्यान में रखते हुए, विश्लेषणात्मक रूप से व्यक्त किया जा सकता है।
3.4. कठोर धातुओं का ऑक्सीकरण
जब मुझे O2 या अन्य ऑक्सीकरण गैसों (CO2, H2O) वाले वातावरण में रखा जाता है, तो इसकी सतह ऑक्साइड से ढक जाती है, पैमानाजिसकी मोटाई समय के साथ बढ़ती जाती है। उच्च तापमान पर यह प्रक्रिया होती है उच्च तापमान संक्षारण- बहुत तेजी से विकसित होता है और रोलिंग या फोर्जिंग से पहले गर्म करने पर मी की हानि होती है।
कुल मिलाकर, मी के ऑक्सीकरण के कारण प्रति वर्ष 18...20 मिलियन टन मी नष्ट हो जाता है। मी ऑक्सीकरण एक सहज प्रक्रिया है, लेकिन यह कई कारकों पर निर्भर करता है।
ऑक्सीकरण प्रक्रिया में निम्नलिखित चरण होते हैं:
1) ऑक्साइड सतह पर ऑक्सीकरण गैस का बाहरी प्रसार;
2) स्केल परत में आंतरिक प्रसार;
3) इंटरफेस पर रासायनिक क्रिया (प्रतिक्रिया)।
मोटाई y का स्केल (MeO) दो मीडिया के बीच स्थित है - Me और गैस के बीच; इसकी सीमा के भीतर, O2 सांद्रता गैस/MeO इंटरफ़ेस से MeO/Me इंटरफ़ेस तक कम हो जाती है, और Me सामग्री विपरीत दिशा में घट जाती है। इसके लिए धन्यवाद, ऑक्साइड परत में पदार्थों का प्रसार संभव है, जैसा कि चित्र में दिखाया गया है। 3.7.

चावल। 3.7. धातु ऑक्सीकरण योजना
ठोस पैमाने में प्रसार गुणांक इसकी क्रिस्टल संरचना पर निर्भर करता है, जो ऑक्साइड (VMeO) और Me (VMe) के मोल अंशों के अनुपात से निर्धारित होता है।
जब VМе > VMeO बनता है झरझराऑक्साइड परत जिसके माध्यम से ऑक्सीकरण करने वाली गैस आसानी से मुझमें प्रवेश कर जाती है। निम्नलिखित मेस में ये गुण हैं।
मेनऑन | Na2O | |||
यदि वी.एम.ई< VMeO, то оксид покрывает Ме сплошным плотным покровом, который создает значительное диффузионное сопротивление и окисление затрудняется. К данной группе относятся следующие Ме:
मेनऑन | Al2O3 | Cu2O | Cr2O3 | Fe2O3 |
|
वास्तविक धातु ऑक्सीकरण की स्थितियों में, बाहरी गैस का प्रसार अपेक्षाकृत तेज़ी से होता है, इसलिए किसी भी धातु के ऑक्सीकरण की प्रक्रिया को दो चरणों में दर्शाया जा सकता है:
1) ऑक्साइड फिल्म के माध्यम से O2 (एक अन्य ऑक्सीकरण एजेंट) का प्रसार;
2) इंटरफ़ेस पर रासायनिक संपर्क का प्रत्यक्ष कार्य।
आइए हम T = स्थिरांक पर ऑक्सीकरण समय t पर ऑक्साइड परत की मोटाई y की निर्भरता के लिए एक समीकरण प्राप्त करें।
प्रक्रिया की गति का अवलोकन किया
वोब्स = डाई/डीटी।
आंतरिक प्रसार की दर को इस प्रकार परिभाषित किया गया है

जहां "-" एकाग्रता प्रवणता है;
स्पोव, सोब - प्रतिक्रिया सतह पर और गैस की मात्रा में ऑक्सीकरण एजेंट की सांद्रता;

रासायनिक प्रतिक्रिया की दर को इस प्रकार परिभाषित किया गया है
n = 1 के साथ, https://pandia.ru/text/79/398/images/image057_8.gif" width='115 ऊंचाई=52' ऊंचाई='52'>
स्थिर अवस्था में, क्रमिक लिंक K की गति और कुल गति एक दूसरे के बराबर होती है:
![]()
इस मामले में, हम स्पोव को प्रसार समीकरण में प्रतिस्थापित करते हैं:

y = f (t) – अवकल समीकरण.
चलिए चलते हैं और वेरिएबल्स को अलग करते हैं:

प्रारंभिक स्थितियाँ: t = 0, y = 0.

समय पर ऑक्सीकृत प्रसार परत की मोटाई की मांगी गई निर्भरता:
![]() (*)
(*)
यह फ़ंक्शन परवलयिक है.
t = 0 और y® 0, y2 पर<< y, поэтому величиной y2/2 пренебрегаем:
y = Kx C Rev × t। (3.6)
यह रिश्ता रैखिक है.
यह संकेत करता है:
1) स्केल परत की मोटाई ~ टी, यानी ऑक्सीकरण एक स्थिर दर पर होता है;
2) ऑक्सीकरण दर Kx मान की विशेषताओं द्वारा निर्धारित की जाती है, अर्थात प्रतिक्रिया गतिज क्षेत्र में होती है।
यह समूह I की धातुओं पर लागू होता है।
दूसरे समूह डी की धातुओं के लिए< R; при этом t – велико. В этом случае слагаемым пренебрегаем и получаем:
![]()
![]() . (3.7)
. (3.7)
1) स्केल परत की मोटाई आनुपातिक है, यानी समय के साथ ऑक्सीकरण दर कम हो जाती है;
2) प्रक्रिया प्रसार क्षेत्र में होती है।
इसे चित्र में ग्राफ़िक रूप से दिखाया गया है। 3.8.
इस प्रकार, मेरे लिए घने पैमाने के साथ, ऑक्सीकरण प्रतिक्रिया शुरू में होती है गतिज क्षेत्रऔर ऑक्साइड परत एक रैखिक निर्भरता के अनुसार बढ़ती है (चित्र 3.8 - जोन 1 में)।
एक महत्वपूर्ण परत मोटाई के साथ, निर्भरता परवलयिक हो जाती है और प्रक्रिया सीमित हो जाती है आंतरिक प्रसार(जोन 2). इन चरम मामलों के बीच संक्रमण क्षेत्र - 3 है, जहां y और t एक अंतर समीकरण (*) से संबंधित हैं, जो रासायनिक परिवर्तन और प्रसार की विशेषताओं को ध्यान में रखता है।

चावल। 3.8. प्रक्रिया समय पर पैमाने की मोटाई की निर्भरता: 1 - गतिज क्षेत्र;
2 - प्रसार क्षेत्र; 3- संक्रमण क्षेत्र
4. धातु पुनर्स्थापन प्रक्रियाएँ
4.1. कमी प्रक्रियाओं की थर्मोडायनामिक विशेषताएं
यौगिकों के पृथक्करण की बहुत कम लोच के कारण उनके ऑक्साइड के पृथक्करण के माध्यम से शुद्ध धातुओं का उत्पादन थर्मोडायनामिक रूप से असंभावित है।
धातुओं को उनके ऑक्साइड से अपचयन द्वारा प्राप्त करने की प्रक्रिया सबसे उपयुक्त है। ऐसी प्रक्रिया अनिवार्य रूप से रेडॉक्स है (ऑक्सीकृत धातु कम हो जाती है और कम करने वाला एजेंट ऑक्सीकृत हो जाता है) और आम तौर पर प्रतिक्रिया द्वारा वर्णित किया जा सकता है
मीओ + बी = मी + बीओ, डीजीटी(4.1) , (4.1)
जहां ठोस और गैसीय पदार्थ (तत्व) दोनों को कम करने वाले एजेंट बी के रूप में उपयोग किया जा सकता है।
प्रतिक्रिया (4.1) अनिवार्य रूप से फॉर्म की गठन प्रतिक्रियाओं का योग है
बी = = वीओ, डी जी टी (4.2); (4.2)
Ме = = МеО, डी जी Т(4.3), (4.3)
जो ऊष्माक्षेपी हैं।
प्रतिक्रिया की सहज घटना (4.1) संभव है यदि D G Т(4.2)< D G Т(4.3).
4.2. ठोस और गैसीय द्वारा आयरन ऑक्साइड का अपचयन
संरक्षणकर्ताओं
आयरन ऑक्साइड के लिए सार्वभौमिक कम करने वाला एजेंट ठोस कार्बन है; गैसों को कम करते समय अक्सर CO और H2 का उपयोग किया जाता है।
ठोस और गैसीय कम करने वाले एजेंटों के साथ लौह ऑक्साइड की कमी की प्रक्रियाओं की थर्मोडायनामिक्स सिद्धांत रूप में समान है।
कार्बन मोनोऑक्साइड CO का उपयोग करते समय, FemOn - CO - CO 2 प्रणाली में संतुलन पर विचार किया जाना चाहिए, जिसे निम्नलिखित प्रतिक्रियाओं द्वारा वर्णित किया गया है:
(4.4)
EN-US">EN-US">स्थिति: पूर्ण; z-सूचकांक:5;बाएं:0px;मार्जिन-बाएं:234px;मार्जिन-शीर्ष:12px;चौड़ाई:11px;ऊंचाई:88px">  (4.8)
(4.8)

चावल। 4.1. प्रणाली के गैस चरण की संतुलन संरचनाफेमऑन - CO - CO 2
आरेख Fe 2O 3 चरण के स्थिर अस्तित्व का क्षेत्र नहीं दिखाता है, क्योंकि गणना के अनुसार, यह चरण CO सामग्री> 0.01% पर भी विचाराधीन तापमान सीमा में अस्थिर है।
बिंदु O तीन ठोस चरणों के गैस चरण के साथ अपरिवर्तनीय संतुलन का एक बिंदु है।
हाइड्रोजन या किसी अन्य कम करने वाले एजेंट को कम करने वाले एजेंट के रूप में उपयोग करते समय, संतुलन गैस संरचना वक्र की गणना इसी तरह की जाएगी।
जब कार्बन का उपयोग आयरन ऑक्साइड के लिए कम करने वाले एजेंट के रूप में किया जाता है, तो प्रक्रिया को उन प्रतिक्रियाओं द्वारा वर्णित किया जा सकता है जो सिस्टम में संतुलन के अनुरूप होती हैं
Fe 2O 3 - Fe 3O 4 - FeO - Fe - C - CO - CO 2, जिसमें सात घटक होते हैं।
हालाँकि, Fe 2O 3 की अस्थिरता को ध्यान में रखते हुए, निम्नलिखित रासायनिक संतुलन का विश्लेषण करने की सलाह दी जाती है:
Fe3O4 + CO = 3FeO + CO2;
FeO + CO = Fe + CO2;
2CO = C + CO2.
आंशिक संतुलन के अलावा, चरण नियम के अनुसार, पांच चरणों का एक साथ संतुलन संभव है - चार ठोस और गैसीय (सीओ और सीओ2 का मिश्रण)।
इन प्रतिक्रियाओं के संतुलन वक्र चित्र में दिखाए गए हैं। 4.2.
फ़ॉन्ट-आकार:13.0pt">चित्र 4.1. संतुलन मोनोऑक्साइड सामग्री
ऑक्साइड की अप्रत्यक्ष कमी के दौरान कार्बन
लौह और ठोस कार्बन गैसीकरण प्रतिक्रियाएँ
विचाराधीन प्रणाली में संतुलन की मात्रात्मक विशेषताओं को गैस चरण की संरचना पर स्थिरांक की निर्भरता को व्यक्त करने वाले समीकरणों को संयुक्त रूप से हल करके प्राप्त किया जा सकता है। इन समीकरणों की प्रणाली के समाधान से यह निष्कर्ष निकलता है कि प्रणाली में बढ़ते दबाव के साथ, तापमान जिस पर लोहे के आक्साइड की कमी बढ़ने लगती है, और घटते दबाव के साथ, इसके विपरीत।
इस प्रकार, ठोस कार्बन की उपस्थिति में Fe-O प्रणाली में चरण संतुलन गैस चरण के तापमान और कुल दबाव से निर्धारित होता है
(सीओ+सीओ2).
4.3. पुनर्प्राप्ति प्रक्रियाओं का तंत्र और गतिकी
गैसों और ठोस कम करने वाले एजेंटों द्वारा धातु ऑक्साइड की कमी के तंत्र अलग-अलग हैं और उनकी अपनी विशेषताएं हैं।
गैसों द्वारा कम किए जाने पर यह प्रक्रिया कम से कम तीन चरणों में होती है:
1) प्रतिक्रिया सतह पर कमी का सोखना;
2) ऑक्साइड जाली से ऑक्सीजन का संक्रमण और एक नए ठोस चरण के एक साथ गठन के साथ कम करने वाले एजेंट के सोखने वाले अणुओं के साथ इसका संयोजन।
3) गैसीय अपचयन उत्पादों का अवशोषण।
इस सिद्धांत को सोखना-ऑटोकैटलिटिक कहा जाता है, और तंत्र को निम्नलिखित चित्र द्वारा दर्शाया जा सकता है:
MeO(s) + B(गैस) = MeO(s) × B(विज्ञापन),
MeO(s) × B(विज्ञापन) = Me(s) × VO(विज्ञापन),
मी(एस) × वीओ(विज्ञापन) = मी(एस) × वीओ(गैस)
MeO(s) + B(गैस) = Me(s) × VO(गैस)।
एक दो-चरणीय योजना भी है, जिसमें आणविक ऑक्सीजन के निर्माण के साथ ऑक्साइड के पृथक्करण का चरण और गैस चरण में एक कम करने वाले एजेंट के साथ संयोजन का चरण शामिल है।
सोखना-ऑटोकैटलिटिक सिद्धांत के अनुसार, कटौती की प्रक्रिया ऑटोकैटलिटिक है - एक ठोस प्रतिक्रिया उत्पाद का निर्माण इसके गठन की प्रक्रिया को तेज करता है। इस मामले में, गैस अणुओं को कम करने का सोखना अलग-अलग विकसित होता है - संरचना के आधार पर। कमी के एक निश्चित चरण में, ऑटोकैटलिसिस की अधिकतम विशेषता देखी जाती है, जो कमी की गतिज व्यवस्था से मेल खाती है।
सामान्य तौर पर, गैसों द्वारा धातु ऑक्साइड के अपचयन की गतिज प्रक्रिया विषम होती है, जिसमें निम्नलिखित चरण शामिल होते हैं:
1) गैस प्रवाह से कम ऑक्साइड की सतह तक कम करने वाले एजेंट का बाहरी प्रसार;
2) कम करने वाले एजेंट के ठोस उत्पाद की परत के छिद्रों और जाली दोषों के माध्यम से प्रतिक्रिया अंश तक कम करने वाले एजेंट का आंतरिक प्रसार;
3) एक रासायनिक प्रतिक्रिया जिसके बाद धातु ऑक्साइड का क्रिस्टल-रासायनिक परिवर्तन धातु तक निचले स्तर में होता है;
4) आंतरिक और बाहरी प्रसार के कारण गैसीय कमी उत्पादों को गैस धारा में हटाना।
इनमें से कोई भी चरण, सैद्धांतिक रूप से, सीमित हो सकता है, यानी पुनर्प्राप्ति प्रक्रिया की गति निर्धारित कर सकता है। प्रसार और रासायनिक परिवर्तन की दर के आधार पर, चरणबद्ध या क्षेत्रीय कमी संभव है, जो अनुक्रम के सिद्धांत से मेल खाती है।
गतिज शासन में एक चरणबद्ध प्रकार की प्रक्रिया देखी जाती है, एक क्षेत्रीय प्रकार - प्रसार शासन में। प्रसार और रासायनिक प्रतिक्रिया की तुलनीय दरों पर, कमी की प्रक्रिया मिश्रित, या प्रसार-गतिज मोड में आगे बढ़ेगी, जो सबसे जटिल है।
गैसों द्वारा कमी की दर विभिन्न कारकों से प्रभावित होती है, जिनमें से मुख्य निम्नलिखित हैं: ऑक्साइड सामग्री के टुकड़ों का आकार, अयस्कों की सरंध्रता, कम करने वाली गैस की प्रवाह दर, गैस की संरचना, दबाव और तापमान।
धातु ऑक्साइड की प्रत्यक्ष कमी की प्रतिक्रियाएँ गैसों के साथ कमी की तुलना में अधिक जटिल होती हैं।
ठोस कार्बन द्वारा ऑक्साइड की कमी का आकलन प्रतिक्रिया द्वारा किया जा सकता है
MeO(s) + C(s) = Me(s) + CO2.
हालाँकि, यह समीकरण प्रक्रिया के वास्तविक तंत्र को प्रतिबिंबित नहीं करता है, जो मध्यवर्ती उत्पादों के रूप में गैसों की भागीदारी के साथ कई चरणों में होता है।
ऑक्साइड की कार्बन-थर्मल कमी के लिए कई योजनाएँ हैं
एक दो-चरणीय योजना विकसित की गई है और समीकरणों द्वारा इसका प्रतिनिधित्व किया गया है
MeO + CO = मी + CO2
सी + सीओजी = 2सीओ
मीओ + सी = मी + सीओ.
उपरोक्त योजना के अनुसार, ठोस कार्बन के साथ धातु ऑक्साइड की परस्पर क्रिया CO गैस के साथ घट जाती है। इससे प्रत्यक्ष कटौती प्रक्रियाओं को समझाने के लिए सोखना-उत्प्रेरक सिद्धांत को लागू करना संभव हो जाता है, और गैसीकरण प्रतिक्रिया के माध्यम से सीओ के पुनर्जनन में ठोस कार्बन की भूमिका कम हो जाती है। काइनेटिक रूप से, इस योजना के अनुसार, उन धातुओं को पुनर्स्थापित करना संभव है जो गैसों (Fe, Ni, Cu, आदि) द्वारा आसानी से कम हो जाती हैं। इस योजना के अनुसार अंतःक्रिया की निचली तापमान सीमा कम तापमान पर कार्बन गैसीकरण प्रतिक्रिया की कम दर से जुड़ी होती है, और यह चरण अक्सर सीमित होता है। इसलिए, धातु ऑक्साइड की प्रत्यक्ष कमी की प्रक्रिया के लिए निर्णायक कारक गैसीकरण प्रतिक्रिया की दर को प्रभावित करने वाले कारक हैं - तापमान, कार्बन गतिविधि और उत्प्रेरक की उपस्थिति।
एक विघटनकारी योजना है, जिसके अनुसार ऑक्साइड के पृथक्करण की प्रक्रिया संभव है, जिसके बाद योजना के अनुसार कार्बन के साथ ऑक्सीजन की परस्पर क्रिया होती है।
मैं = मैं + 1/2O2
C + 1/2Og = CO
मीओ + सी = मी + सीओ.
यह योजना उच्च पृथक्करण लोच (Mn O2, Pb O2, Cu O, Co 3O4) वाले ऑक्साइड के लिए स्वीकार्य है।
ऑक्साइड-ऊर्ध्वपातन योजना विकसित की गई; इस परिकल्पना के अनुसार, कई ऑक्साइड की कमी ऑक्साइड के उर्ध्वपातन (ऊर्ध्वपातन) के माध्यम से हो सकती है, जिसके बाद कार्बन सतह पर इसके वाष्पों का संघनन (सोखना) होता है:
MeO (सोल) = MeO (गैस)
MeO (गैस) + C(s) = MeO (विज्ञापन) C(s)
मीओ (विज्ञापन) सी (टीवी) = मी (टीवी) सीओ (विज्ञापन)
मी (टीवी) · सीओ (विज्ञापन) = मी (टीवी) + सीओ (गैस)
MeO (s) + C (s) = Me (s) + CO (गैस)।
यह योजना अस्थिर ऑक्साइड (Mo O3, W O3, Cr 2O3) दोनों के लिए विशिष्ट है और 630...870 K पर उनकी कमी की व्याख्या करती है, जब कार्बन गैसीकरण और थर्मल पृथक्करण की कम प्रतिक्रिया दर के कारण अन्य योजनाओं के अनुसार बातचीत असंभव है ऑक्साइड का, और मजबूत ऑक्साइड (Al 2O3, Mg O, Zn O2) के लिए, जिसका उर्ध्वपातन ऑक्साइड वाष्प और निचले गैसीय ऑक्साइड (Al 2O, Si O) के निर्माण के साथ होता है।
संपर्क कटौती योजना के अनुसार, संपर्क ठोस चरणों - ऑक्साइड और कार्बन के संपर्क बिंदुओं पर होता है। सीधे संपर्क के बाद, उत्पाद की एक अलग परत बनती है, और इस परत के माध्यम से अभिकर्मकों के प्रसार के साथ पुनर्प्राप्ति होती है।
गैस-कार्बाइड योजना के ढांचे के भीतर कार्बोथर्मिक कमी की कई नियमितताओं को समझाया गया है: प्रक्रिया की दर पर सीओ का प्रभाव, प्रतिक्रियाशील मिश्रण से दूर के क्षेत्रों में संघनन उत्पादों में कार्बन की उपस्थिति, सूजन का प्रभाव अयस्क-कोयला छर्रों, ऑटोकैटलिसिस।
इस प्रकार, विभिन्न ऑक्साइड अलग-अलग योजनाओं के अनुसार कार्बन के साथ बातचीत कर सकते हैं, जबकि अन्य को मुख्य तंत्र के साथ एक साथ महसूस किया जा सकता है। कमी प्रक्रिया में प्रत्येक तंत्र का हिस्सा स्थितियों के आधार पर भिन्न होता है - तापमान, दबाव, अभिकर्मकों के मिश्रण की डिग्री और कमी की डिग्री, और अन्य कारक।
5 . धातुकर्म पिघलाव
5.1. सामान्य विशेषताएँ
उच्च तापमान वाली धातुकर्म प्रक्रियाएं तरल चरणों की भागीदारी के साथ होती हैं: धातु, ऑक्साइड (स्लैग), सल्फाइड (मैट), नमक। तरल चरणों के बीच और गैस चरणों की अनिवार्य भागीदारी के साथ बातचीत धातुकर्म पिघलने की संरचना (संरचना) और गुणों पर निर्भर करती है।
प्रकृति और संरचना को ध्यान में रखते हुए सभी तरल पदार्थों को इस प्रकार वर्गीकृत किया गया है:
1) हाइड्रोजन बांड (पानी, अल्कोहल, कार्बनिक अम्ल) के साथ;
2) आणविक बंधन (बेंजीन, पैराफिन) के साथ;
3) आयनिक बंधनों के साथ (ऑक्साइड और सल्फाइड पिघला हुआ, जलीय और लवण, क्षार, एसिड के अन्य समाधान);
4) धातु बंधों के साथ (मुक्त इलेक्ट्रॉनों के साथ धनायनों की परस्पर क्रिया)।
धातुकर्म प्रक्रियाओं में भाग लेने वाले ऑक्साइड और सल्फाइड पिघलने बहुघटक तरल पदार्थ होते हैं और एक जटिल संरचना होती है। पिघले हुए लवणों में, जिन्हें आयनिक तरल पदार्थ के रूप में वर्गीकृत किया जाता है, मजबूत अंतरकण अंतःक्रिया और प्रति इकाई आयतन में कणों की उच्च सांद्रता देखी जाती है। औद्योगिक धातु पिघलने बहुघटक तरल पदार्थ होते हैं जिनमें धात्विक और उपधातु घटक होते हैं।
किसी दी गई संरचना की धातु पिघलते समय, वे स्लैग और गैस चरण के साथ मिश्रधातु तत्वों के नुकसान को कम करने का प्रयास करते हैं। यह संपर्क चरणों के बीच तत्वों के पुनर्वितरण के पैटर्न के ज्ञान और धातुकर्म पिघलने में घटकों की थर्मोडायनामिक गतिविधि की गणना करने की क्षमता से सुगम होता है।
ऐसी समस्याओं को हल करने के लिए, पिघल की संरचना (संरचना) और पिघल की संरचनात्मक इकाइयों के बीच कार्य करने वाली ताकतों की प्रकृति को जानना आवश्यक है। सिस्टम में होने वाली प्रक्रियाओं की दर का आकलन करने के लिए, पिघलने के कई भौतिक-रासायनिक गुणों का ज्ञान आवश्यक है।
पिघल की संरचना या संरचना को उसके घटक कणों की अंतरिक्ष में सापेक्ष स्थिति के मात्रात्मक विवरण के रूप में समझा जाता है। पिघल की संरचना कणों की इलेक्ट्रॉनिक प्रकृति, कणों के बीच परस्पर क्रिया बलों के परिमाण और इसके भौतिक-रासायनिक गुणों के साथ जुड़ी हुई है, जिन्हें अक्सर संरचना-संवेदनशील गुण कहा जाता है।
5.2. धातु पिघलती है
शुद्ध तरल धातुओं को आमतौर पर तथाकथित सरल तरल पदार्थों के रूप में वर्गीकृत किया जाता है, जो वैन डेर वाल इंटरैक्शन बलों के साथ तरलीकृत अक्रिय गैसें हैं। तरल धातुओं में, अंतरकणीय संचार एकत्रित इलेक्ट्रॉनों द्वारा किया जाता है; उनकी उपस्थिति विद्युत चालकता, तापीय चालकता, साथ ही चिपचिपाहट और सोखना के साथ-साथ धातुओं के अन्य गुणों की व्याख्या करती है।
क्रिस्टलीकरण तापमान के करीब तापमान पर, तरल धातुओं की संरचना ठोस क्रिस्टलीय निकायों की संरचना के करीब होती है। यह समानता अंतरकण अंतःक्रिया की प्रकृति और थर्मोडायनामिक गुणों की तुलनीयता में निहित है। तरल अवस्था में, परमाणु (आयन) निकट दूरी पर होते हैं, लेकिन कड़ाई से आवधिक नियमित संरचना नहीं बनाते हैं, यानी ठोस क्रिस्टलीय निकायों की लंबी दूरी की क्रम विशेषता।
धातु में विभिन्न अशुद्धता तत्वों (मिश्र धातु तत्वों सहित) का परिचय पिघल की इलेक्ट्रॉनिक संरचना को बदलता है, और अशुद्धता की प्रकृति के आधार पर, पिघल में इसके अस्तित्व का रूप विलायक के अस्तित्व के रूप से भिन्न होता है।
इस प्रकार, मैंगनीज, क्रोमियम, निकल और अन्य धातु जैसे तत्व जो इलेक्ट्रॉनिक संरचना में लोहे से बहुत कम भिन्न होते हैं, उनकी तरल लोहे में असीमित घुलनशीलता और ठोस लोहे में उच्च घुलनशीलता होती है। वे क्रिस्टल जाली में कुछ नोड्स पर कब्जा करते हुए, लोहे के साथ संस्थागत ठोस समाधान बनाते हैं।
कार्बन, नाइट्रोजन और हाइड्रोजन जैसे तत्व लौह क्रिस्टल जाली के अंतराल में स्थित होकर, लोहे के साथ अंतरालीय विलयन बनाते हैं।
सिलिकॉन और फॉस्फोरस तरल लोहे में असीमित रूप से घुलते हैं, लेकिन ठोस लोहे में उनकी घुलनशीलता सीमित होती है। लोहे के पिघलने पर वे सिलिकॉन और फास्फोरस के साथ लोहे के परमाणुओं के अलग-अलग समूह बनाते हैं, जिनमें सहसंयोजक बंधों की प्रधानता होती है।
तरल लोहे (या अन्य विलायक) में घुली अशुद्धियाँ धातु के पिघलने के गुणों को बदल देती हैं और इस्पात निर्माण प्रक्रियाओं की प्रकृति को प्रभावित करती हैं। इन गुणों में चिपचिपाहट, सतह गुण, घनत्व, विद्युत चालकता और तापीय चालकता शामिल हैं।
5.3. धातु के पिघलने के थर्मोडायनामिक गुण।
इंटरेक्शन विकल्प
धातु पिघलती है, जो अनिवार्य रूप से समाधान हैं, उन कणों के बीच एक जटिल भौतिक और रासायनिक संपर्क की विशेषता होती है जिनसे वे बने होते हैं। धातुकर्म प्रणालियों के थर्मोडायनामिक विवरण की विश्वसनीयता एक विशेष थर्मोडायनामिक सिद्धांत के विकास की डिग्री से निर्धारित होती है। इसके अलावा, अपनाई गई कुछ मान्यताओं की प्रकृति के आधार पर, सांख्यिकीय सिद्धांतों को सख्त सिद्धांतों (उदाहरण के लिए, क्वांटम मैकेनिकल) में विभाजित किया जाता है; संख्यात्मक प्रयोग पर आधारित सिद्धांत; मॉडल सिद्धांत.
उत्तरार्द्ध काफी व्यापक हो गए हैं - यह सही समाधान का सिद्धांत, आदर्श तनु समाधान का सिद्धांत, नियमित समाधान का सिद्धांत और अन्य हैं। ऐसे सिद्धांतों की शुरुआत का एक कारण समाधान के सामान्य थर्मोडायनामिक मॉडल की कमी है।
धातु के पिघलने के थर्मोडायनामिक गुणों का वर्णन करते समय, उपयोग किए गए मॉडलों के बीच इंटरेक्शन पैरामीटर विधि का सबसे अधिक उपयोग किया जाता है।
इस विधि का उपयोग प्रश्न में घटक की गतिविधि पर समाधान के सभी घटकों के प्रभाव को ध्यान में रखने के लिए किया जाता है (उदाहरण के लिए, घटक ए विलायक है, घटक बी, सी और डी अतिरिक्त अशुद्धियाँ हैं)। अतिरिक्त मुक्त ऊर्जा के टेलर श्रृंखला विस्तार के परिणामस्वरूप इंटरैक्शन पैरामीटर निर्धारित किए जाते हैं ![]() शुद्ध विलायक के संगत बिंदु के निकट घटक बी के लिए:
शुद्ध विलायक के संगत बिंदु के निकट घटक बी के लिए:
https://pandia.ru/text/79/398/images/image083_4.gif" width=”39″ ऊंचाई=”25″> अशुद्धता तत्वों के मोल अंशों के अनुसार प्रथम क्रम के दाढ़ अंतःक्रिया पैरामीटर कहलाते हैं, दूसरा - दूसरा क्रम https://pandia.ru/text/79/398/images/image086_4.gif' width='28' ऊंचाई='28'>.
इसे ध्यान में रखते हुए, विघटित घटकों (बी, सी, डी, ...) के कम मूल्यों वाले समाधानों के लिए अभिव्यक्ति (5.1) को फॉर्म में लिखा जा सकता है
या i-वें घटक के लिए
 . (5.2)
. (5.2)
बहुघटक समाधानों के लिए, आमतौर पर 1% तनु समाधान को पदार्थ की मानक अवस्था के रूप में लिया जाता है। इस स्थिति में हम (5.2) के स्थान पर लिखते हैं
या सामान्य तौर पर  (5.3)
(5.3)
यहाँ 
5.4. लावा पिघल जाता है. संरचना, संरचना, थर्मोडायनामिक गुण
मेटलर्जिकल स्लैग एक बहुघटक (मुख्य रूप से ऑक्साइड) समाधान है जो धातु के पिघलने और धातुकर्म इकाई के गैस चरण के साथ संपर्क करता है। स्लैग में सल्फाइड, फ्लोराइड और अन्य गैर-धात्विक समावेशन हो सकते हैं। धातु गलाने के दौरान, स्लैग सबसे महत्वपूर्ण तकनीकी कार्य करता है (उदाहरण के लिए, इकाई के वातावरण से धातु की रक्षा करना; धातु से हानिकारक अशुद्धियों का अवशोषण; ऑक्सीडेटिव प्रक्रियाओं में भागीदारी; धातु का प्रसार डीऑक्सीडेशन)।
स्लैग पिघल की संरचना संरचनात्मक इकाइयों की प्रकृति और अंतरिक्ष में उनके वितरण से निर्धारित होती है। ठोस और तरल स्लैग के एक्स-रे विवर्तन अध्ययन की मदद से किए गए स्लैग पिघलने के बुनियादी भौतिक रासायनिक गुणों - चिपचिपापन, प्रसार, सोखना का एक व्यापक अध्ययन से पता चला है कि पिघली हुई अवस्था में, पिघले हुए स्लैग में आयन होते हैं - धनायन और ऋणायन।
स्लैग की संरचना उनके मुख्य गुणों को महत्वपूर्ण रूप से प्रभावित करती है, जिनमें से मूलभूतता पर प्रकाश डाला जाना चाहिए - स्पष्ट मूल गुणों वाले ऑक्साइड और अम्लीय गुणों वाले ऑक्साइड की एकाग्रता का अनुपात। इसके अलावा, संरचना के आधार पर, स्लैग को मूल में विभाजित किया जाता है (उनमें मूल ऑक्साइड का प्रभुत्व होता है - CaO, MgO, MnO, आदि) और अम्लीय (SiO 2, Al 2O 3, TiO 2)।
स्लैग की संरचना और इसकी संरचना भौतिक और रासायनिक गुणों को प्रभावित करती है: घनत्व, सतह गुण, चिपचिपापन, प्रसार।
घनत्व और दाढ़ की मात्रा संरचना-संवेदनशील गुण हैं; इन विशेषताओं का उपयोग आयनिक पिघल के गतिज गुणों की गणना के लिए किया जाता है। रचना का प्रभाव समन्वय संख्या में परिवर्तन से निर्धारित होता है और मुक्त मात्रा में परिवर्तन की विशेषता होती है। तापमान पर निर्भरता परमाणु कंपन के आयाम में वृद्धि के कारण अंतरपरमाणु दूरी में बदलाव से जुड़ी है।
सतह के गुणों का विश्लेषण करते समय, यह पाया गया कि अधिकांश बाइनरी प्रणालियों के लिए सतह का तनाव संरचना में परिवर्तन के साथ रैखिक रूप से भिन्न होता है।
स्लैग पिघलने की एक अन्य महत्वपूर्ण विशेषता चिपचिपाहट है, जो 0.1...1.0 Pa s (सिलिकॉन-ऑक्सीजन कॉम्प्लेक्स जैसी बड़ी संरचनात्मक इकाइयों की उपस्थिति के कारण) के भीतर भिन्न होती है, जो धातु पिघलने की तुलना में अधिक है।
गतिशील श्यानता η और गतिज ν संबंध η = 1/ν से संबंधित हैं।
तापमान पर श्यानता की निर्भरता समीकरण द्वारा व्यक्त की जाती है
η = Аер(Еη/RT ),
जहां Eη श्यान प्रवाह की सक्रियण ऊर्जा है।
स्लैग पिघलने के थर्मोडायनामिक गुणों को विभिन्न सिद्धांतों - आणविक और आयनिक का उपयोग करके वर्णित किया गया है, जो क्रिस्टलीकृत स्लैग की खनिज संरचना के अध्ययन के परिणामों और प्रयोगात्मक डेटा के सामान्यीकरण पर आधारित हैं।
जी शेंक द्वारा विकसित तरल स्लैग की संरचना के आणविक सिद्धांत का संस्करण सरल है और इस कथन पर आधारित है कि मुक्त ऑक्साइड (CaO, SiO 2, FeO ...) के अणुओं और उनके यौगिकों को इकाई माना जाता है। स्लैग की संरचनाएँ.
विभिन्न प्रकार के ऑक्साइड यौगिकों में से, 5 का चयन किया गया: 2FeO·SiO2, 3CaO·Fe3O4, 2MnO·SiO2, CaO·SiO2, 4CaO·P2O5। ये यौगिक संतोषजनक रूप से स्लैग गुणों की एक विस्तृत श्रृंखला का वर्णन करते हैं, जिसमें दिए गए यौगिकों की पृथक्करण प्रतिक्रियाओं के संतुलन स्थिरांक के आधार पर धातु और स्लैग के बीच तत्वों का वितरण भी शामिल है।
हालाँकि, स्लैग पिघलने के आणविक सिद्धांत की मुख्य विशेषता और नुकसान स्लैग पिघलने की वास्तविक संरचना पर विचार की कमी है। फिर भी, संचित सामग्री हमें कुछ थर्मोडायनामिक विशेषताओं का मूल्यांकन करने की अनुमति देती है - उदाहरण के लिए, एआई घटकों की गतिविधि।
पूर्ण आयनिक समाधान का सिद्धांत (लेखक) इस कथन पर आधारित है कि स्लैग समाधान पूरी तरह से आयनों (धनायनों और आयनों) में अलग हो जाता है; एक ही चिन्ह के आयन ऊर्जावान रूप से समान होते हैं; प्रत्येक आयन के निकटतम पड़ोसी विपरीत चिह्न के आयन हैं; समाधान मात्रा में बदलाव के बिना बनता है; तापीय गति के दौरान, एक ही चिह्न के आयनों के बीच पुनर्व्यवस्था संभव है। ऐसे पिघल के घटकों की गतिविधि की गणना धनायनों और आयनों के आयनिक अंशों के उत्पाद के रूप में की जाती है।
उदाहरण के लिए, कैल्शियम सल्फाइड CaS की गतिविधि संबंध द्वारा निर्धारित की जाएगी
![]()
जहां xCa, xS क्रमशः कैल्शियम धनायन और सल्फर आयनों के आयन अंश हैं।
पूर्ण आयनिक समाधान के सिद्धांत का उपयोग अत्यधिक बुनियादी स्लैग में घटकों की गतिविधियों को निर्धारित करने के लिए किया जा सकता है, हालांकि, SiO 2 और Al 2O 3 के अनुपात को 20% तक बढ़ाने से सिद्धांत और प्रयोग के बीच एक मजबूत विसंगति होती है, इसलिए इस सिद्धांत का उपयोग नहीं किया जाता है व्यावहारिक संतुलन गणना में.
हालाँकि, इस मॉडल के मुख्य स्थिर प्रावधान विकसित और परीक्षण किए गए नियमित आयनिक समाधानों के सिद्धांत में लागू होते हैं।
इस सिद्धांत की विशेषताओं में निम्नलिखित प्रावधान शामिल हैं: समाधान की एन्ट्रापी को आदर्श नहीं माना जाता है और इसकी गणना पूर्ण आयनिक समाधान के सिद्धांत के अनुसार की जाती है; समाधान में सबसे सरल परमाणु आयन होते हैं (धनायन - धातु आयन Ca2+, Fe 2+, Al 3+, और आयन - धातु आयन O2–, F–, S 2–); आयनों के निकटतम पड़ोसी विपरीत चिह्न के आयन हैं; ऊष्मा के निकलने या अवशोषण के साथ, आयतन में बदलाव किए बिना घोल बनता है।
किसी समाधान के घटकों की रासायनिक क्षमता की गणना करते समय - साथ ही घटकों की गतिविधि का निर्धारण करते समय; इस सिद्धांत में, Qij घटकों के मिश्रण की ऊर्जा को ध्यान में रखना आवश्यक है, जो कि धनायनों i और j वाले यौगिकों के समाधानों के प्रयोगात्मक अध्ययन के परिणामों के आधार पर पाया जाता है। इस सिद्धांत की विशेषता यह है कि संरचना और थर्मोडायनामिक कार्यों के बीच संबंध अधिक सख्ती से और उचित रूप से स्थापित होता है, इसलिए गणना की सटीकता और विश्वसनीयता अधिक होती है।
स्लैग पिघलने के पोलीमराइजेशन सिद्धांत में, यह स्वीकार किया जाता है कि समाधान बनाने वाले आयन ऊर्जावान रूप से असमान होते हैं, और पॉलिमराइज्ड कॉम्प्लेक्स बनते हैं जिसमें समाधान की अन्य संरचनात्मक इकाइयों के साथ कॉम्प्लेक्स की बाध्यकारी ऊर्जा बनती है।
इलेक्ट्रॉनों की एक सामूहिक प्रणाली के साथ चरणों के रूप में समाधान के सिद्धांत के अनुसार (मूल सिद्धांत विकसित किए गए हैं), रासायनिक यौगिकों को नहीं, बल्कि आवर्त सारणी के तत्वों को स्लैग समाधान के एक घटक के रूप में चुना जाता है, इसलिए समाधान की संरचना है परमाणु अंशों में व्यक्त किया गया। इस मामले में, समाधान के सभी परमाणुओं के इलेक्ट्रॉन एक एकल क्वांटम यांत्रिक प्रणाली बनाते हैं। स्लैग समाधान में Am Bn यौगिक की गतिविधि इस प्रकार निर्धारित की जाती है
![]() ,
,
जहां https://pandia.ru/text/79/398/images/image095_3.gif" width='23' ऊंचाई='25 src='> - तत्व A और B की गतिविधियां।
प्रकार के एक तत्व की गतिविधि इस घटक के परमाणु अंश और घटक जे के साथ बातचीत की ऊर्जा से निर्धारित होती है। इस मामले में, अंतःक्रियात्मक ऊर्जा Еij को इस प्रकार निर्धारित किया जाता है
Еij =1/2(χ1/2 – χ1/2)2,
जहां χi और χj परमाणु i और j के परमाणु पैरामीटर हैं, जो विभिन्न यौगिकों के निर्माण की मानक एन्थैल्पी के मूल्यों से निर्धारित होते हैं।
6. इस्पात में गैसें. नाइट्राइड निर्माण प्रक्रियाएँ
उच्च तापमान वाली धातुकर्म प्रक्रियाओं की विशेषता स्लैग और गैस चरणों के साथ धातु के पिघलने की परस्पर क्रिया है। मुख्य रूप से तरल धातुओं के साथ गैसों की परस्पर क्रिया की पूर्णता और गति धातु उत्पादों की गुणवत्ता निर्धारित करती है।
तरल धातु में द्विपरमाणुक गैसों (ऑक्सीजन, हाइड्रोजन और नाइट्रोजन) का विघटन एक ही प्रकार का होता है, ए सिवर्ट्स नियम (वर्गमूल नियम के रूप में जाना जाता है) का पालन करता है और प्रतिक्रिया के अनुसार होता है
प्रतिक्रिया का संतुलन स्थिरांक (6.1) का रूप है
, (6.2) कहाँ ![]()
किसी धातु में =1 एटीएम पर संतुलन गैस सांद्रता [जी] को घुलनशीलता कहा जाता है और यह दो-घटक धातु-गैस प्रणाली के लिए प्रतिक्रिया के संतुलन स्थिरांक (6.1) के संख्यात्मक रूप से बराबर है।
1600 डिग्री सेल्सियस के तापमान पर, तरल लोहे में ऑक्सीजन की सीमित घुलनशीलता 0.22%, नाइट्रोजन के लिए - 0.044%, हाइड्रोजन के लिए - 0.0026% है।
अधिकांश धातुओं (लोहा, निकल, आदि) में गैसों के विघटन की प्रक्रिया एंडोथर्मिक होती है, इसलिए बढ़ते तापमान के साथ, गैसों की घुलनशीलता बढ़ जाती है। अपवाद -Fe में नाइट्रोजन की घुलनशीलता है, जो एक संशोधन से दूसरे संशोधन (-Fe -Fe, -Fe) में लोहे के चरण संक्रमण के बिंदुओं पर बढ़ते तापमान के साथ घट जाती है https://pandia.ru/text/79/398 /images/image102_2.gif " width='13' ऊंचाई='20 src='>-Fe ) और पिघलने के दौरान (-Fe EN-US">Fe -l), घोल में गैसों की संतुलन सांद्रता अचानक बदल जाती है।
(6.2) के अनुसार गैसों की घुलनशीलता दबाव से भी प्रभावित होती है। बढ़ते दबाव के साथ, प्रतिक्रिया का संतुलन (6.1) कम संख्या में गैस मोल्स की ओर, यानी दाईं ओर स्थानांतरित हो जाता है। सीवर्ट्स के नियम की व्यवहार्यता परिणामी समाधान की आदर्शता को इंगित करती है। धातु में घुले अन्य घटकों की उपस्थिति में, गैसों की संतुलन सांद्रता भिन्न हो जाती है। विघटित गैस के साथ घटक की बातचीत के मापदंडों का उपयोग करके इस प्रभाव को ध्यान में रखा जा सकता है।
यदि<0, происходит снижение коэффициента активности газа в расплаве и повышение его растворимости. Например, элементами, повышающими растворимость водорода в железе, являются титан, ниобий, ванадий. Снижению растворимости водорода в железе способствуют такие элементы, как углерод, алюминий , кремний (для них >0).
लगभग इसी क्रम में ये घटक नाइट्रोजन के सक्रियता गुणांक और उसकी घुलनशीलता को प्रभावित करते हैं।
लोहे और उसके मिश्र धातुओं के क्रिस्टलीकरण के दौरान हाइड्रोजन और नाइट्रोजन की घुलनशीलता में भारी कमी के साथ कई अवांछनीय घटनाएं भी होती हैं। आणविक रूप में हाइड्रोजन को क्रिस्टलीकृत धातु के दोषपूर्ण क्षेत्रों (माइक्रोवोइड्स) में अलग किया जाता है। जैसे-जैसे बाद के प्लास्टिक प्रसंस्करण के दौरान इन सूक्ष्म दोषों का आकार घटता जाता है, यह उच्च दबाव बनाता है, जिसके परिणामस्वरूप धातु में तनाव उत्पन्न होता है, जिससे लचीलेपन में कमी आती है, साथ ही निरंतरता का उल्लंघन भी होता है।
लोहे या निकल पर आधारित पिघलने में नाइट्रोजन की घुलनशीलता पर मिश्रधातु तत्वों के प्रभाव का आकलन प्रयोगात्मक रूप से स्थापित तत्वों का उपयोग करके किया जा सकता है।
जब नाइट्रोजन नाइट्राइड बनाने वाले तत्वों के साथ मिश्रित पिघल के साथ संपर्क करती है, तो गैस चरण के साथ संतुलन में Fe-R-N समाधान बनाना संभव होता है, और आर सामग्री में वृद्धि के साथ, नाइट्रोजन की घुलनशीलता बढ़ जाती है।
आर घटक की कुछ सामग्री पर, एक दुर्दम्य यौगिक, नाइट्राइड आरएन, पिघल से अलग हो सकता है। उपसमूह Ti, Zr, Hf के तत्वों Iva में नाइट्रोजन के प्रति सबसे अधिक आकर्षण है, जिनका उपयोग मुख्य रूप से तरल धातु में नाइट्रोजन को बांधने के लिए किया जाता है।
घोल से निकलने वाले बिखरे हुए कार्बाइड धातु की लचीलेपन में भारी कमी लाते हैं और इसकी कठोरता को बढ़ाते हैं।
धातु के पिघलने के साथ नाइट्रोजन की परस्पर क्रिया की ख़ासियतें मी-आरएन चरण आरेख में परिलक्षित होती हैं, आइसोथर्मल खंड का एक टुकड़ा जिसमें धातु से समृद्ध क्षेत्रों में चित्र में दिखाया गया है। 6.1.
चरण स्थिरता के क्षेत्रों को सीमित करने वाली रेखाओं का वर्णन संतुलन थर्मोडायनामिक्स के संगत समीकरणों द्वारा किया जाता है।
जैसा कि आरेख से देखा जा सकता है, नाइट्राइड बनाने वाले तत्व की थोड़ी मात्रा के साथ, गैसीय नाइट्रोजन के साथ तरल चरण की स्थिरता का दो-चरण क्षेत्र होता है। इस क्षेत्र (I) और द्रव स्थिरता के क्षेत्र (II) को अलग करने वाली रेखा AB के निर्देशांक समीकरण का विश्लेषण करके निर्धारित किए जा सकते हैं:
एटीएम पर, नाइट्रोजन की गतिविधि प्रतिक्रिया के संतुलन स्थिरांक (1) के बराबर होती है। बिंदु A पर नाइट्रोजन सांद्रता Me-N बाइनरी सिस्टम में इसकी घुलनशीलता के बराबर है।

चित्र.6.1. मी-आर-एन प्रणाली के राज्य आरेख के एक आइसोथर्मल खंड की योजना
चित्र में. चित्र 6.1 निम्नलिखित चरण स्थिरता क्षेत्रों को दर्शाता है:
मैं - एफ + एन2,
द्वितीय - एफ,
III - एफ + आरएन,
IV - एफ + आरएन + एन 2।
नाइट्राइड निर्माण इज़ोटेर्म (बीसीडी) और Fe-R-N पिघल में नाइट्रोजन की घुलनशीलता के अनुरूप रेखा (एबी) का प्रतिच्छेदन फ़ॉन्ट-फ़ैमिली पर पिघलता है: प्रतीक"> - आरएन यौगिक के अनुरूप बिंदु पर [आर] एकाग्रता त्रिकोण , और एटीएम पर शुद्ध नाइट्रोजन के अनुरूप बिंदु पर बीई रेखा।
7. धातु के पिघलने का डीऑक्सीडेशन
स्टील-गलाने वाली इकाई में स्टील के पिघलने की ऑक्सीडेटिव अवधि के दौरान, धातु में प्रवेश करने वाली ऑक्सीजन (गैस जेट द्वारा धातु स्नान में उड़ाए गए ऑक्सीकरण स्लैग से) का उपयोग मुख्य रूप से अशुद्धियों (सी, एस, पी, सी) के ऑक्सीकरण के लिए किया जाता है। ) और कुछ मिश्रधातु घटक, लेकिन इसका कुछ भाग धातु के पिघलने में रह जाता है।
शुद्ध लौह धातुमल के तहत लोहे में ऑक्सीजन की घुलनशीलता का अनुमान प्रतिक्रिया के आधार पर लगाया जाता है
(FeO) = +. (7.1)
![]() .
.
चिपमैन ने पाया कि प्रतिक्रिया के लिए (7..gif" width=”176 ऊंचाई=47″ ऊंचाई=”47″>.
T = 1600°C (1873K) पर लोहे में ऑक्सीजन की सीमित घुलनशीलता 0.21% है।
हालाँकि, वास्तविक गलाने की स्थिति में, स्टील स्लैग में FeO के अलावा, कई ऑक्साइड और अन्य समावेशन होते हैं। इसलिए, तरल स्टील में ऑक्सीजन सामग्री घुलनशीलता सीमा तक नहीं पहुंचती है और 0.06...0.08 के स्तर पर होती है। इस मामले में, जब धातु के पिघलने पर 0.05...0.06% C से अधिक होता है, तो धातु में ऑक्सीजन की मात्रा कार्बन ऑक्सीकरण प्रतिक्रिया के विकास से निर्धारित होती है
+ = (सीओ)। (7.2)
जब धातु पिघलकर T = 1873 K पर संतुलन अवस्था में पहुंच जाती है, तो संबंध · = 0.0025 संतुष्ट होना चाहिए, हालांकि, औद्योगिक इकाइयों में स्टील पिघलने की वास्तविक स्थितियों में, कार्बन ऑक्सीकरण प्रतिक्रिया संतुलन तक नहीं पहुंचती है - विशेष रूप से, के कारण CO बुलबुले के निर्माण के लिए परिस्थितियाँ। इस संबंध में, ऑक्सीकरण स्लैग के तहत स्टील पिघलने के दौरान, धातु में ऑक्सीजन सामग्री संतुलन से अधिक होती है और 0.15% से कम कार्बन सामग्री पर पहुंचती है। चित्र में. चित्र 7.1 पिघली हुई धातु में कार्बन सामग्री पर ऑक्सीजन सामग्री की निर्भरता को दर्शाता है।

चावल। 7.1 लौह-कार्बन पिघलने में ऑक्सीजन सामग्री में परिवर्तन: 1 - संतुलन वक्र; 2 - स्टील पिघलने की वास्तविक सांद्रता का क्षेत्र
सभी प्रकार की प्रक्रियाओं के लिए स्टील में वास्तविक ऑक्सीजन सांद्रता एक क्षेत्र में आती है। यह इंगित करता है कि > 0.05...0.06 पर, कार्बन ऑक्सीकरण प्रतिक्रिया का स्टील में ऑक्सीजन सामग्री पर निर्णायक प्रभाव पड़ता है। पर< 0,05…0,06 содержание кислорода в металле соответствует равновесному с углеродом и бывает ниже его. Следовательно, равновесное со шлаком содержание кислорода в Me достигает величин, соответствующих равновесию с углеродом или даже меньше их.
प्रतिक्रिया (7.2) ऊष्माक्षेपी है, इसलिए, पिघली हुई धातु के ठंडा होने और क्रिस्टलीकरण होने पर, P=const पर · का मान कम हो जाता है; अतिरिक्त ऑक्सीजन सांद्रता और भी अधिक हो जाती है, जिससे गैस के बुलबुले का निर्माण होता है, पिंड का घनत्व कम हो जाता है, और क्रिस्टलीकरण धातु की अनाज सीमाओं के साथ सल्फाइड के साथ लौह ऑक्साइड और उसके समाधान के समावेश की रिहाई होती है। ये ऑक्सीसल्फाइड अपने कम गलनांक के कारण धातु को लाल भंगुरता प्रदान करते हैं।
तत्वों का पृथक्करण, विशेष रूप से ऑक्सीजन, का भी एक मजबूत प्रभाव होता है: क्रिस्टलीकरण के दौरान, बढ़ते क्रिस्टल के सामने प्रारंभिक समाधान में इसकी सामग्री तरल धातु की मात्रा में औसत से काफी अधिक होती है, जो कार्बन के तीव्र ऑक्सीकरण का कारण बनती है।
इस संबंध में, अंतिम गलाने की अवधि के मुख्य कार्यों में से एक तरल चरण से अतिरिक्त ऑक्सीजन को हटाना है, जो धातु पिघल के डीऑक्सीडेशन के माध्यम से प्राप्त किया जाता है।
डीऑक्सीडेशन को तरल स्टील में ऑक्सीजन सामग्री को कम करने के लिए ऑपरेशन के एक सेट के रूप में समझा जाता है।
डीऑक्सीडेशन के मुख्य कार्य हैं:
- लोहे की तुलना में ऑक्सीजन के लिए अधिक आकर्षण वाले तत्वों को जोड़कर तरल लोहे में ऑक्सीजन सामग्री को एक स्तर तक कम करना जो घने धातु के उत्पादन को सुनिश्चित करता है;
- तरल स्टील से डीऑक्सीडेशन उत्पादों को अधिक पूर्ण रूप से हटाने के लिए स्थितियां बनाना।
यदि पहली समस्या को रासायनिक ऊष्मागतिकी के नियमों का उपयोग करके माना जाता है, तो दूसरी को रासायनिक गतिकी के उपकरण का उपयोग करके हल किया जाता है।
थर्मोडायनामिक दृष्टिकोण तरल स्टील में ऑक्सीजन सामग्री और डीऑक्सीडाइजिंग तत्व आर की सामग्री के बीच संबंध की पहचान करना, इस रिश्ते की प्रकृति पर तापमान के प्रभाव की डिग्री निर्धारित करना और न्यूनतम ऑक्सीजन सामग्री की गणना करना भी संभव बनाता है। तत्व आर द्वारा डीऑक्सीडाइज़ होने पर धातु पिघल जाती है।
डीऑक्सीडेशन की सबसे आम विधि वर्षा या गहरी विधि है, जिसके अनुसार लोहे की तुलना में ऑक्सीजन (सी, अल, सीए) के लिए अधिक आकर्षण वाले तत्वों को धातु में गहराई से पेश किया जाता है। ये तत्व ऑक्सीजन को टिकाऊ गैर-धातु समावेशन (आमतौर पर ऑक्साइड) में बांधते हैं, जिनकी लोहे में घुलनशीलता FeO की घुलनशीलता से कई गुना कम होती है। इन समावेशन को एक महीन निलंबन के रूप में एक अलग चरण में विभाजित किया जाता है, जो स्टील की तुलना में कम घनत्व वाला होता है, आंशिक रूप से स्लैग में तैरता है, और आंशिक रूप से गैर-धातु समावेशन के रूप में क्रिस्टलीकृत धातु में रहता है, जिससे इसकी स्थिति खराब हो जाती है। गुणवत्ता।
अवक्षेपण (गहरे) डीऑक्सीडेशन को फॉर्म की प्रतिक्रिया द्वारा वर्णित किया जा सकता है
![]() . (7.3)
. (7.3)
शर्त के तहत, इस प्रतिक्रिया का संतुलन स्थिरांक रूप लेगा
 (7.4)
(7.4)
जहां एआई पिघल में आई-वें घटक की गतिविधि है।
पिघले हुए घटकों की गतिविधियों की गणना करने के लिए, 1% पतला घोल आमतौर पर मानक अवस्था के रूप में लिया जाता है।
प्रतिक्रिया में संतुलन स्थापित होने पर प्रसार डीऑक्सीडेशन प्राप्त होता है
(FeO) = +[O]
यह विधि अमिश्रणीय तरल चरणों - मी और स्लैग के बीच पदार्थ के संतुलन वितरण के प्रयास के विचार पर आधारित है। ऐसे में रिश्ता पूरा हो जाता है
 (7.5)
(7.5)
जब स्लैग में आयरन ऑक्साइड की गतिविधि कम हो जाती है, तो ऑक्सीजन धातु में चरण सीमा तक फैल जाती है और Fe 2+ और O 2- आयनों के जोड़े के रूप में स्लैग में चली जाती है।
विधि का लाभ ऑक्सीजन हटा दिए जाने के बाद धातु में किसी भी प्रतिक्रिया उत्पाद की अनुपस्थिति है।
यह विधि गैस चरण में थोड़ी मात्रा में स्लैग और कम ऑक्सीजन सामग्री वाले चिपबोर्ड में लागू की जाती है। अन्य इस्पात निर्माण इकाइयों में, प्रक्रिया की कम गति के कारण आज प्रसार डीऑक्सीडेशन का उपयोग नहीं किया जाता है।
अक्सर, कम FeO सामग्री (1% से कम) के साथ सिंथेटिक नींबू-एल्यूमिना स्लैग के साथ एक करछुल में तरल स्टील का इलाज करते समय प्रसार डीऑक्सीडेशन का उपयोग सहवर्ती प्रक्रिया के रूप में किया जाता है। जब धातु को छोटी बूंदों में कुचल दिया जाता है, तो धातु-स्लैग संपर्क सतह हजारों गुना बढ़ जाती है; संवहन धाराओं की उपस्थिति न केवल डीऑक्सीडेशन की प्रक्रिया को तेज करती है, बल्कि स्टील के डीसल्फराइजेशन को भी तेज करती है।
डीऑक्सीडेशन की एक अन्य विधि वैक्यूम डीऑक्सीडेशन है, जो डीकार्बोनाइजेशन प्रतिक्रिया सी (7.2) पर आधारित है।
दबाव में कमी इस प्रतिक्रिया के संतुलन को आगे की दिशा में स्थानांतरित कर देती है। इस विधि का लाभ धातु में डीऑक्सीडेशन उत्पादों की अनुपस्थिति है। यह विधि स्टील के आउट-ऑफ-फर्नेस प्रसंस्करण के दौरान कार्यान्वित की जाती है।
जटिल डीऑक्सीडाइज़र के उपयोग के आधार पर एक जटिल डीऑक्सीडेशन होता है - दो या दो से अधिक घटकों (सिलिकोकैल्शियम, सिलिकोमैंगनीज, आदि) के मिश्र धातु। ऐसे डीऑक्सीडाइज़र के उपयोग के फायदे डीऑक्सीडेशन की थर्मोडायनामिक स्थितियों में महत्वपूर्ण सुधार और न्यूक्लिएशन, विस्तार और गैर-धातु समावेशन को हटाने के लिए अधिक अनुकूल गतिज स्थितियों से पूर्व निर्धारित हैं।
इस प्रकार, सिलिकॉन द्वारा डीऑक्सीडेशन के दौरान Fe में Mn मिलाने से Fe की डीऑक्सीडाइजिंग क्षमता में वृद्धि होती है।
दूसरे घटक के प्रभाव में बढ़ती डीऑक्सीडाइजिंग क्षमता के प्रभाव को जटिल डीऑक्सीडेशन उत्पादों में परिणामी ऑक्साइड की थर्मोडायनामिक गतिविधि में कमी से समझाया गया है, जो अलग-अलग डीऑक्सीडेशन वाले उत्पादों से काफी भिन्न होता है।
किसी तत्व की डीऑक्सीडाइजिंग क्षमता को लोहे (धातु) में घुली ऑक्सीजन की संतुलन सांद्रता के रूप में समझा जाता है, जो किसी दिए गए तापमान पर इस तत्व की एक निश्चित सामग्री के अनुरूप होती है। जाहिर है, किसी दिए गए डीऑक्सीडाइज़र सामग्री के लिए यह सांद्रता जितनी कम होगी, तत्व की डीऑक्सीडाइज़िंग क्षमता उतनी ही अधिक होगी।
एम/एन एलजी [आर] - एम/एन एलजी एफआर - एलजी एफओ। (7.9)
समीकरण (7.10) के दाहिने पक्ष को शून्य के बराबर करने और इसे आर के लिए हल करने पर, हम धातु में न्यूनतम ऑक्सीजन सामग्री के अनुरूप डीऑक्सीडाइज़र आर की एकाग्रता पाते हैं; इस मामले में, घटकों के गतिविधि गुणांक के मान संबंधों (7.7) और (7.8) से पाए जाते हैं:
 (7.11)
(7.11)
 (7.12)
(7.12)
संबंध (7.12) से मान [आर] को समीकरण (7.9) में प्रतिस्थापित करते हुए, हम तत्व आर द्वारा डीऑक्सीडाइज्ड धातु पिघल में न्यूनतम ऑक्सीजन एकाग्रता निर्धारित करते हैं:
 (7.13)
(7.13)
चित्र में. तालिका 7.2 टी = 1600 डिग्री सेल्सियस पर तरल लोहे में कुछ तत्वों की डीऑक्सीडाइजिंग क्षमताओं को दर्शाती है।
ऑक्सीजन की मात्रा जटिल रूप से निर्भर करती है। डीऑक्सीडाइज़र की कम सांद्रता पर, जैसे-जैसे आर बढ़ता है, ऑक्सीजन की मात्रा कम हो जाती है। और अधिक वृद्धि से धातु में ऑक्सीजन सांद्रता में वृद्धि होती है। हालाँकि, गतिविधि गुणांक में कमी के कारण ऑक्सीजन सामग्री में वृद्धि के साथ, ऑक्सीजन गतिविधि कम हो जाती है, जिसकी पुष्टि प्रयोगात्मक डेटा से होती है। चित्र में तरल लोहे में ऑक्सीजन सामग्री के वक्रों में टूटता है। 7.1 डीऑक्सीडाइज़र की सामग्री में परिवर्तन होने पर विभिन्न डीऑक्सीडेशन उत्पादों के निर्माण का परिणाम है।
डीऑक्सीडेशन उत्पादों का न्यूक्लियेशन एक सजातीय चरण (तथाकथित सहज न्यूक्लिएशन) या तैयार सतहों (कुल दीवारों की सतह, स्लैग, निलंबित समावेशन, डीऑक्सीडाइज़र पर ऑक्साइड फिल्में) में हो सकता है।
सभी मामलों में, नए चरणों का न्यूक्लियेशन उतार-चढ़ाव के परिणामस्वरूप होता है - कणों (परमाणुओं, आयनों) का एक यादृच्छिक संचय जो धातु में औसत सामग्री से संरचना में भिन्न होता है। ये उतार-चढ़ाव, उनके परिमाण और बाहरी स्थितियों के आधार पर, गायब हो सकते हैं या, एक निश्चित ऊर्जा बाधा को पार करके, समावेशन में विकसित हो सकते हैं।

चावल। 7.2 T = 1600°C पर तरल लोहे में तत्वों की डीऑक्सीडेशन क्षमता
यह प्रयोगात्मक रूप से पुष्टि की गई है कि एक सजातीय प्रणाली में, जब एक नए चरण के नाभिक बनते हैं, तो ऑक्सीजन के लिए बढ़ी हुई आत्मीयता वाले और "धातु और नए चरण के नाभिक" के बीच इंटरफेस पर सबसे बड़ी सतह तनाव पैदा करने वाले शुरू में उनमें प्रवेश करते हैं। . समावेशन की बाद की वृद्धि के साथ, एक नए चरण के निर्माण में शामिल सक्रिय घटकों की एकाग्रता कम हो जाती है। पिघल के वे घटक जो उतार-चढ़ाव में अलग होने वाले ऑक्साइड की थर्मोडायनामिक गतिविधि को कम करने में मदद करते हैं, नाभिक के निर्माण की सुविधा प्रदान करते हैं, और जो धातु में डीऑक्सीडाइज़र और ऑक्सीजन की गतिविधि को कम करने में मदद करते हैं, वे उनके पृथक्करण को और अधिक कठिन बनाते हैं।
गैस सतहों पर समावेशन के न्यूक्लियेशन के मामले में, सजातीय चरणों के लिए ऊपर बताए गए चरणों के अलावा, पृथक्करण चरण के साथ सतह को गीला करने का प्रभाव महत्वपूर्ण है। संपर्क कोण जितना छोटा होगा, नाभिक के उतार-चढ़ाव उतने ही छोटे होंगे। नाभिक का निर्माण उन पदार्थों के अधिमान्य पृथक्करण द्वारा सुगम होता है जो चरण इंटरफ़ेस पर केशिका सक्रिय होते हैं।
संतुलन अवस्था से एक महत्वपूर्ण विचलन के मामले में, सजातीय न्यूक्लियेशन निर्णायक होता है। जैसे-जैसे किसी विशेष घटक की सुपरसैचुरेशन कम होती जाती है, न्यूक्लिएशन केंद्रों के रूप में तैयार सतहों की भूमिका बढ़ती जाती है। तैयार सतहों का प्रभाव, विशेष रूप से ठोस समावेशन को अलग करते समय, अलग-अलग समावेशन और मौजूदा सब्सट्रेट के क्रिस्टल के अभिविन्यास और आयामी पत्राचार जितना अधिक प्रभावी होता है।
न्यूक्लियेटेड समावेशन (उनका प्रारंभिक आकार लगभग 1 एनएम है) टकराव पर कणों के जमावट (संयोजन) के परिणामस्वरूप बड़ा हो जाता है और समाधान के सुपरसैचुरेशन के कारण इन कणों पर धातु के पिघलने से पदार्थ की रिहाई होती है। जमावट दर कण टकराव की आवृत्ति और दक्षता से प्रभावित होती है, जो ब्राउनियन गति के कारण होती है, साथ ही गति की गति में अंतर के कारण होती है, जो असमान कण आकार और घनत्व और संवहनी धाराओं की उपस्थिति के कारण होती है।
संवहन धाराएँ धातु की गहराई से धातु-स्लैग इंटरफ़ेस तक डीऑक्सीडेशन उत्पादों की डिलीवरी सुनिश्चित करती हैं। धातु-स्लैग सीमा पर एक समावेशन की गति बलों की एक श्रृंखला के परिणाम की दिशा और परिमाण द्वारा निर्धारित की जाती है: उत्प्लावन (आर्किमिडीयन) एफ ए, जो धातु और स्लैग के घनत्व में अंतर के कारण होता है और लंबवत ऊपर की ओर निर्देशित होता है; केशिका एफ कैप, केशिका-सक्रिय पदार्थों की सांद्रता प्रवणता के कारण होता है और उनकी उच्च सांद्रता की ओर निर्देशित होता है; जड़त्वीय - केन्द्रापसारक एफ सी, प्रक्षेपवक्र की वक्रता के कारण होता है और धातु में गहराई से निर्देशित होता है, क्योंकि समावेशन का घनत्व स्टील के घनत्व से कम होता है, और जड़त्वीय बल एफ और, जिसकी दिशा गति की दिशा पर निर्भर करती है कण: स्वतंत्र रूप से तैरने वाले समावेशन के लिए इसे लंबवत ऊपर की ओर निर्देशित किया जाता है, और प्रवाह द्वारा परिवहन किए जाने वाले कणों के लिए - प्रवाह की दिशा के साथ मेल खाता है।
समावेशन के आकार और आकार, धातु और स्लैग के डीऑक्सीडेशन और प्रवाह के हाइड्रोडायनामिक्स के आधार पर, कण जिस गति से स्लैग सतह तक पहुंचता है उस पर इनमें से प्रत्येक बल का प्रभाव अलग-अलग होता है। बड़े समावेशन मुख्य रूप से उत्प्लावन बलों की कार्रवाई के तहत सीमा तक पहुंचते हैं, छोटे वाले - केशिका बलों की कार्रवाई के तहत, विशेष रूप से ऑक्सीजन एकाग्रता के एक बड़े ढाल के साथ।
जैसे-जैसे सतह क्षेत्र जिस पर ये बल कार्य करते हैं, कम होता जाता है, दबाव बढ़ता है और धातु की परत तेजी से टूटती है। तेज किनारों के साथ अनियमित आकार के ठोस समावेशन के साथ इस तरह के प्रतिरोध को दूर करना आसान है, और सपाट लोगों के साथ अधिक कठिन है।
इस प्रकार, जितना अधिक पूरी तरह से स्टील को डीऑक्सीडाइज़ किया जाता है और उसमें से समावेशन हटा दिए जाते हैं, तैयार धातु की गुणवत्ता उतनी ही अधिक होती है।
8. धातु और धातुमल के बीच तत्वों का वितरण
धातु और स्लैग चरणों के बीच तरल धातु या किसी धातु (तत्व) के अशुद्धता तत्वों का वितरण ऑक्सीजन के लिए तत्वों की रासायनिक आत्मीयता, स्लैग की संरचना, धातु और स्लैग में एक दूसरे के साथ तत्वों की बातचीत पर निर्भर करता है। , और तापमान।
स्लैग की रासायनिक संरचना का प्रभाव अशुद्धता तत्व के ऑक्सीकरण के दौरान बनने वाले ऑक्साइड के रासायनिक गुणों से जुड़ा होता है।
तापमान का प्रभाव अशुद्धता ऑक्सीकरण प्रतिक्रिया के थर्मल प्रभाव और ऑक्साइड के स्लैग में संक्रमण के संकेत के आधार पर प्रकट होता है, जो आमतौर पर सकारात्मक होता है (ΔН< 0).
धातु और स्लैग के बीच रासायनिक प्रतिक्रिया के परिणामस्वरूप होने वाले तत्वों के वितरण को पदार्थ ली के वितरण गुणांक का उपयोग करके चित्रित किया जा सकता है।
यह संकेतक, कुछ शर्तों के तहत, एक चरण से दूसरे चरण में संक्रमण के दौरान इस अशुद्धता की इलेक्ट्रॉनिक स्थिति में परिवर्तन के साथ ऑक्सीडेटिव प्रतिक्रिया के कारण अशुद्धता के वितरण की एक मात्रात्मक विशेषता हो सकता है।
संतुलन वितरण सूचकांक को किसी तत्व की ऑक्सीकरण प्रतिक्रिया के संतुलन स्थिरांक से व्यक्त किया जा सकता है, जो उदाहरण के लिए, धातु और स्लैग पिघलने के संपर्क चरणों की बातचीत के दौरान होता है:
एक्स [ई] + वाई (एफईओ) = (पूर्व ओ वाई) + वाई; (8.1)
 . (8.2)
. (8.2)
(8.2) को ध्यान में रखते हुए, तत्व का वितरण गुणांक [ई] इस प्रकार व्यक्त किया जाएगा:
 . (8.3)
. (8.3)
समीकरण (8.3) का विश्लेषण हमें तत्वों के एक चरण से दूसरे चरण में स्थानांतरण के लिए स्थितियों की पहचान करने की अनुमति देता है: धातु से स्लैग तक या इसके विपरीत। नीचे धातु और धातुमल के बीच कुछ तत्वों के वितरण के उदाहरण दिए गए हैं।
सिलिकॉन के लिए, इंटरफेशियल वितरण प्रतिक्रिया का संतुलन इस प्रकार व्यक्त किया जाएगा
2(FeO) = (SiO2 ) + 2; (8.4)
 .
(8.5)
.
(8.5)
धातु से पिघले हुए धातुमल में सिलिकॉन के अधिकतम संक्रमण की स्थितियाँ इस प्रकार होंगी:
1) तापमान को कम करना, जो किसी दिए गए रासायनिक प्रतिक्रिया ΔH के लिए KSi के मान को बढ़ाने की अनुमति देता है< 0;
2) स्लैग और धातु ऑक्सीकरण में गतिविधि (FeO) में वृद्धि [%O];
3) स्लैग में Si युक्त कणों की गतिविधि गुणांक में कमी;
4) धातु के पिघलने में Si गतिविधि में वृद्धि।
शर्तें 2 और 3 स्लैग की एक निश्चित बुनियादीता पर पूरी होती हैं: % CaO में वृद्धि Ca 2+ आयनों के साथ उनके समूह के कारण Si युक्त कणों की गतिविधि गुणांक को कम कर देती है।
सिलिकॉन में ऑक्सीजन के प्रति उच्च आकर्षण है, इसके लिए EN-US"> 2[P] + 5(FeO) + 4(CaO) = (4(CaO) (P 2 O 5 )) + 5; (8.6)
 (8.7)
(8.7)
स्लैग में फॉस्फोरस युक्त कणों की गतिविधि CaO सामग्री बढ़ने के साथ कम हो जाती है, जो 4CaO · P 2O 5 जैसे समूहों के गठन से जुड़ी है। विश्लेषण (8.6) और (8.7) से यह पता चलता है कि फॉस्फोरस के अधिक पूर्ण हस्तांतरण के लिए धातु से स्लैग तक, EN -US">FeO, साथ ही CaO को बढ़ाना आवश्यक है। इस मामले में, इनमें से एक मात्रा का सबसे बड़ा प्रभाव दूसरे के बढ़े हुए मूल्यों पर दिखाई देता है।
धातु से स्लैग में फॉस्फोरस के अधिकतम स्थानांतरण की शर्तें हैं:
1) स्लैग में FeO (Fe 2+ और O2- आयन) की गतिविधि में वृद्धि, जिससे फॉस्फोरस (P 2O 5) का ऑक्सीकृत रूप प्राप्त करना संभव हो जाता है;
2) स्लैग की CaO सामग्री और बुनियादीता में वृद्धि, जिससे फॉस्फोरस युक्त ऑक्साइड पिघल में कणों की गतिविधि को कम करना संभव हो जाता है;
3) तापमान कम करना: इस कारक को ध्यान में रखा जाना चाहिए, अन्य सभी चीजें समान होने पर, क्योंकि आधुनिक ऑक्सीडेटिव प्रक्रियाओं में तापमान बढ़ने से अधिक बुनियादी प्री-फॉस्फोराइजिंग स्लैग प्राप्त होने पर फॉस्फोरस को हटाने की संभावना कम नहीं होती है;
4) फॉस्फोरस (कार्बन, सिलिकॉन, ऑक्सीजन) के साथ सकारात्मक इंटरैक्शन पैरामीटर वाले तत्वों की धातु पिघल में उपस्थिति।
ग्रंथ सूची
1. धातुकर्म प्रक्रियाओं का सिद्धांत: विश्वविद्यालयों के लिए पाठ्यपुस्तक /, आदि। - एम.: धातुकर्म, 1989. - 392 पी।
2. पोपेल, धातुकर्म प्रक्रियाएं: विश्वविद्यालयों के लिए एक पाठ्यपुस्तक /,। - एम.: धातुकर्म, 1986. - 463 पी.
3. पैडरिन, और धातुकर्म प्रणालियों और प्रक्रियाओं की गणना: विश्वविद्यालयों के लिए एक पाठ्यपुस्तक /,। - एम.: एमआईएसआईएस, 2002. - 334 पी।
4. ग्रिगोरियन, इलेक्ट्रिक स्टील बनाने की प्रक्रियाओं के मूल सिद्धांत: विश्वविद्यालयों के लिए एक पाठ्यपुस्तक /,। - एम.: धातुकर्म, 1989. - 288 पी।
5. कज़चकोव, धातुकर्म प्रक्रियाओं के सिद्धांत पर: विश्वविद्यालयों के लिए एक पाठ्यपुस्तक /। - एम.: धातुकर्म, 1988. - 288 पी।
परिचय………………………………………………………………………… 3
1. उच्च तापमान वाले गैस वातावरण की संरचना और गुण
1.1. गैस वायुमंडल की ऊष्मप्रवैगिकी ……………………………………… 3
1.2. सजातीय गैस प्रक्रियाएं………………………………………….. 7
2. ठोस कार्बन की दहन प्रक्रियाओं का विश्लेषण ……………………………… 9
3. रासायनिक यौगिकों की शक्ति का आकलन ……………………………….. 11
3.1. कार्बोनेटों का पृथक्करण ………………………………………….. 12
3.2. लौह आक्साइड का पृथक्करण……………………………………………… 13
3.3. पृथक्करण प्रक्रियाओं का तंत्र और गतिकी ………………………….. 15
3.4. ठोस धातुओं का ऑक्सीकरण…………………………………………………… 18
4. धातु पुनर्प्राप्ति प्रक्रियाएँ
4.1. कमी प्रक्रियाओं की थर्मोडायनामिक विशेषताएं.......... 21
4.2. ठोस और गैसीय द्वारा आयरन ऑक्साइड का अपचयन
कम करने वाले एजेंट…………………………………………………….. 21
4.3. पुनर्प्राप्ति प्रक्रियाओं का तंत्र और गतिकी…………………….. 23
5. धातुकर्म पिघलता है
5.1. सामान्य विशेषताएँ……………………………………………….. 26
5.2. धातु पिघलती है. ………………………………………………………. 27
5.3. धातु के पिघलने के थर्मोडायनामिक गुण। विकल्प
इंटरैक्शन…………………………………………………………28
5.4. लावा पिघल जाता है. संरचना, संरचना, थर्मोडायनामिक गुण...29
6. स्टील्स में गैसें। नाइट्राइड निर्माण की प्रक्रियाएँ……………………………… 31
7. धातु के पिघलने का डीऑक्सीडेशन……………………………………. 34
8. धातु और धातुमल के बीच तत्वों का वितरण………………..…… 40
ग्रंथ सूची …………………………………………………… 43
खोज परिणामों को सीमित करने के लिए, आप खोजे जाने वाले फ़ील्ड निर्दिष्ट करके अपनी क्वेरी को परिष्कृत कर सकते हैं। फ़ील्ड की सूची ऊपर प्रस्तुत की गई है. उदाहरण के लिए:
आप एक ही समय में कई फ़ील्ड में खोज सकते हैं:
लॉजिकल ऑपरेटर्स
डिफ़ॉल्ट ऑपरेटर है और.
ऑपरेटर औरइसका मतलब है कि दस्तावेज़ को समूह के सभी तत्वों से मेल खाना चाहिए:
अनुसंधान एवं विकास
ऑपरेटर याइसका मतलब है कि दस्तावेज़ को समूह के किसी एक मान से मेल खाना चाहिए:
अध्ययन याविकास
ऑपरेटर नहींइस तत्व वाले दस्तावेज़ शामिल नहीं हैं:
अध्ययन नहींविकास
तलाश की विधि
कोई क्वेरी लिखते समय, आप वह विधि निर्दिष्ट कर सकते हैं जिसमें वाक्यांश खोजा जाएगा। चार विधियाँ समर्थित हैं: आकृति विज्ञान को ध्यान में रखते हुए खोज, आकृति विज्ञान के बिना, उपसर्ग खोज, वाक्यांश खोज।
डिफ़ॉल्ट रूप से, खोज आकृति विज्ञान को ध्यान में रखते हुए की जाती है।
आकृति विज्ञान के बिना खोज करने के लिए, वाक्यांश में शब्दों के सामने बस "डॉलर" चिह्न लगाएं:
$ अध्ययन $ विकास
उपसर्ग खोजने के लिए, आपको क्वेरी के बाद तारांकन चिह्न लगाना होगा:
अध्ययन *
किसी वाक्यांश को खोजने के लिए, आपको क्वेरी को दोहरे उद्धरण चिह्नों में संलग्न करना होगा:
" अनुसंधान और विकास "
समानार्थक शब्द से खोजें
खोज परिणामों में किसी शब्द के पर्यायवाची शब्द शामिल करने के लिए, आपको हैश लगाना होगा " #
"किसी शब्द से पहले या कोष्ठक में किसी अभिव्यक्ति से पहले।
एक शब्द पर लागू करने पर उसके तीन पर्यायवाची शब्द तक मिल जायेंगे।
जब कोष्ठक अभिव्यक्ति पर लागू किया जाता है, तो प्रत्येक शब्द में एक पर्यायवाची शब्द जोड़ा जाएगा यदि कोई पाया जाता है।
आकृति विज्ञान-मुक्त खोज, उपसर्ग खोज, या वाक्यांश खोज के साथ संगत नहीं है।
# अध्ययन
समूहन
खोज वाक्यांशों को समूहीकृत करने के लिए आपको कोष्ठक का उपयोग करना होगा। यह आपको अनुरोध के बूलियन तर्क को नियंत्रित करने की अनुमति देता है।
उदाहरण के लिए, आपको एक अनुरोध करने की आवश्यकता है: ऐसे दस्तावेज़ ढूंढें जिनके लेखक इवानोव या पेत्रोव हैं, और शीर्षक में अनुसंधान या विकास शब्द शामिल हैं:
अनुमानित शब्द खोज
अनुमानित खोज के लिए आपको एक टिल्ड लगाना होगा " ~ " किसी वाक्यांश से किसी शब्द के अंत में। उदाहरण के लिए:
ब्रोमिन ~
सर्च करने पर "ब्रोमीन", "रम", "औद्योगिक" आदि शब्द मिलेंगे।
आप अतिरिक्त रूप से संभावित संपादनों की अधिकतम संख्या निर्दिष्ट कर सकते हैं: 0, 1 या 2। उदाहरण के लिए:
ब्रोमिन ~1
डिफ़ॉल्ट रूप से, 2 संपादनों की अनुमति है।
निकटता की कसौटी
निकटता मानदंड के आधार पर खोजने के लिए, आपको एक टिल्ड लगाना होगा " ~ " वाक्यांश के अंत में। उदाहरण के लिए, 2 शब्दों के भीतर अनुसंधान और विकास शब्दों वाले दस्तावेज़ ढूंढने के लिए, निम्नलिखित क्वेरी का उपयोग करें:
" अनुसंधान एवं विकास "~2
अभिव्यक्ति की प्रासंगिकता
खोज में व्यक्तिगत अभिव्यक्तियों की प्रासंगिकता बदलने के लिए, " चिह्न का उपयोग करें ^
"अभिव्यक्ति के अंत में, इसके बाद दूसरों के संबंध में इस अभिव्यक्ति की प्रासंगिकता का स्तर।
स्तर जितना ऊँचा होगा, अभिव्यक्ति उतनी ही अधिक प्रासंगिक होगी।
उदाहरण के लिए, इस अभिव्यक्ति में, "अनुसंधान" शब्द "विकास" शब्द से चार गुना अधिक प्रासंगिक है:
अध्ययन ^4 विकास
डिफ़ॉल्ट रूप से, स्तर 1 है। मान्य मान एक सकारात्मक वास्तविक संख्या हैं।
एक अंतराल के भीतर खोजें
उस अंतराल को इंगित करने के लिए जिसमें किसी फ़ील्ड का मान स्थित होना चाहिए, आपको ऑपरेटर द्वारा अलग किए गए कोष्ठक में सीमा मान इंगित करना चाहिए को.
लेक्सिकोग्राफ़िक छँटाई की जाएगी.
ऐसी क्वेरी इवानोव से शुरू होकर पेत्रोव पर समाप्त होने वाले लेखक के साथ परिणाम देगी, लेकिन इवानोव और पेत्रोव को परिणाम में शामिल नहीं किया जाएगा।
किसी श्रेणी में मान शामिल करने के लिए, वर्गाकार कोष्ठक का उपयोग करें। किसी मान को बाहर करने के लिए, घुंघराले ब्रेसिज़ का उपयोग करें।